циторедуктивная операция что это
Перитонеальный канцероматоз
Перитонеальный канцероматоз
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Национальный центр лечения больных канцероматозом
МНИОИ имени П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Причины возникновения перитонеального канцероматоза
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
Циторедуктивная операция что это
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Федеральный медицинский исследовательский центр им. П.А. Герцена» Минздрава России, Москва
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал НМИРЦ Минздрава РФ
Циторедуктивная операция с внутрибрюшной аэрозольной химиотерапией у больного с псевдомиксомой брюшины
Журнал: Онкология. Журнал им. П.А. Герцена. 2018;7(6): 45-47
Сидоров Д. В., Гришин Н. А., Ложкин М. В., Хомяков В. М., Корниецкая А. Л., Уткина А. Б., Быкасов С. А. Циторедуктивная операция с внутрибрюшной аэрозольной химиотерапией у больного с псевдомиксомой брюшины. Онкология. Журнал им. П.А. Герцена. 2018;7(6):45-47.
Sidorov D V, Grishin N A, Lozhkin M V, Khomyakov V M, Kornietskaia A L, Utkina A B, Bykasov S A. Cytoreductive surgery with intraperitoneal aerosol chemotherapy in a patient with pseudomyxoma peritonei. P.A. Herzen Journal of Oncology. 2018;7(6):45-47.
https://doi.org/10.17116/onkolog2018706145
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
В клиническом наблюдении представлены первый опыт сочетания циторедуктивной операции и интраоперационной внутрибрюшной аэрозольной химиотерапии, обоснование возможности его применения, технические особенности операции.
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий, Москва
Военная медицинская часть, Голицыно, Московская область, Россия, Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Москва, Россия
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Федеральный медицинский исследовательский центр им. П.А. Герцена» Минздрава России, Москва
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал НМИРЦ Минздрава РФ
Основным общепризнанным методом лечения больных карциноматозом брюшины является циторедуктивная операция с гипертермической внутрибрюшной химиотерапией [1]. Однако к применению этой методики имеется ряд противопоказаний и ограничений. С функциональной стороны это нарушение работы мочевыделительной системы, учитывая выраженный нефротоксический эффект препаратов платины, а с технической — необходимость выполнения оптимальной СС0−1-циторедукции [2]. Последнее определяется глубиной проникновения цитостатика. Даже в режиме гипертермии (42—43 °C) она не превышает 3—4 мм. При высоких показателях индекса перитонеальной диссеминации (PCI) добиться размера остаточной опухоли менее 2,5 мм весьма непросто, особенно при поражении висцеральной брюшины. Использование в комбинации с хирургией интраоперационной фотодинамической терапии ограничивается возможностью воздействия на стенку тонкой и толстой кишки, которые, наоборот, экранируют от прямого лазерного излучения [3]. Нами предпринята попытка использования в качестве метода интраоперационного воздействия на опухолевые клетки аэрозольной внутрибрюшной химиотерапии.
Клиническое наблюдение
Больной П., 56 лет, 31.01.18 в ГКБ им. С.П. Боткина выполнено оперативное вмешательство в объеме лапароскопической аппендэктомии, дренирования брюшной полости. При исследовании операционного материала в МНИОИ им. П.А. Герцена выявили фрагменты кистозно-расширенного аппендикса, заполненного муцином, с дисплазией низкой степени в гиперплазированном железистом эпителии. Заключение: муцинозная аппендикулярная неоплазия, low grade, с кистозной трансформацией, муцинозом со стороны серозной оболочки. Больной оставлен под динамическим наблюдением. Самостоятельно обратился в МНИОИ. При УЗИ-обследовании: в полости таза, больше справа, около 40 мл гетерогенной жидкости, выше, в брюшной полости, скудное количество жидкости в виде полоски в межпетлевом пространстве, вокруг печени и селезенки. В брыжейке кишки справа, на уровне мезогастрия единичные лимфатические узлы размером до 6—7 мм. Печень не увеличена, толщина правой доли печени по среднеключичной линии 12 см. Печень с ровным контуром, однородной изоэхогенной структуры. Очаговых образований не выявлено. Протоки и сосуды не расширены. Желчный пузырь обычной формы, стенка не утолщена. Полость желчного пузыря свободна от конкрементов. Поджелудочная железа не увеличена (24 мм, размер тела 14 мм, хвоста 16 мм) с ровным контуром однородной изоэхогенной структуры. Вирсунгов проток не расширен. Селезенка на верхней границе нормы (размер 12,8×7см) с ровным контуром, умеренно гетерогенной и умеренно гиперэхогенной структуры, дополнительные образования не выявлены. Почки нормальных размеров. В нижнем полюсе справа киста размером до 6 мм, контур четкий. ЧЛС не расширены. Паренхима не истончена. Конкременты не выявляются. Парааортально, паракавально по подвздошным сосудам и в паховых областях очаговых образований не выявлено.
12.04.18 циторедуктивная операция; cубтотальная париетальная перитонэктомия; парциальная висцеральная перитонэктомия; субтотальная резекция большого и малого сальника; холецистэктомия. Выполнена аэрозольная внутрибрюшная интраоперационная химиотерапия, СС-0.
Морфологическое исследование удаленного препарата 26.04.18. Макропрепарат: брюшина правого латерального канала общим размером 30×27×1 см; брюшина левого латерального канала размером 29×19×04 см; тазовая брюшина — фрагмент 21×14×2 см; большой сальник размером 90×32×3 см. Микропрепарат: псевдомиксома брюшины низкой степени злокачественности с поражением париетальной брюшины, в том числе тазовой, брюшины большого и фрагментов малого сальника, висцеральной брюшины, капсулы печени и круглой связки. Послеоперационный период протекал без осложнений. Больной выписан на 10-е сутки. Повторно обсужден на консилиуме: рекомендовано динамическое наблюдение.
Обсуждение
PIPAC (pressurized intraperitoneal aerosol chemotherapy) — внутрибрюшная аэрозольная химиотерапия под давлением — это способ доставки цитостатика в закрытую брюшную полость в виде аэрозоля [4]. Создание искусственного градиента давления предусматривает возможность равномерного распределения и поглощения химиопрепарата в закрытой брюшной полости [5]. Имеются данные, что при длительном воздействии карбоксиперитонеума достигается высокая концентрация цитостатика не только в опухолевых очагах, но и в клетчатке забрюшинного пространства [6]. Необходимо отметить, что концентрация цисплатина и доксорубицина, используемая при PIPAC, на порядок меньше, чем при гипертермической химиотерапии, что соответственно отражается на токсичности [7]. Дополнительным стимулом для попытки применения методики послужила статья R. Girshally и соавт. [8], в которой приводятся результаты использования аэрозольной химиотерапии в качестве «неоадъювантного» метода у больных колоректальным раком, псевдомиксомой брюшины, раком яичников. После проведения PIPAC (мед. 3,5±0,9 курса) у больных с высоким показателем PCI (мед. 14,3±5,3) у 21 больного удалось выполнить циторедуктивную операцию с гипертермической химиотерапией, причем у 20 из них с полнотой циторедукции СС 0−1.
Заключение
Конечно, на данном этапе рано говорить о роли и месте аэрозольной химиотерапии в лечении больных карциноматозом брюшины, но первый опыт свидетельствует, что эта гибридная процедура — сочетание лапаротомии и химиотерапии в условиях пневмоперитонеума технически возможна, нетоксична и требует дальнейшей разработки.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Гришин Николай Александрович — канд. мед. наук, ст. науч. сотр. отд. абдоминальной онкологии;
HIPEC: гипертермическая внутрибрюшная химиотерапия
Егиев Валерий Николаевич
В половине случаев при опухолях ЖКТ и репродуктивных органов развивается перитонеальный карциноматоз: метастазы распространяются по всей поверхности брюшины – оболочки внутренних органов и стенок брюшной полости.
HIPEC (hyperthermic intraperitoneal chemotherapy) или гипертермическая внутрибрюшная химиотерапия — это не просто одно из последних достижений онкологии и самый современный метод лечения метастазов в брюшине, но и множество спасенных жизней, годы вместо отведенных месяцев.
В чем сложность лечения перитонеального карциноматоза?
Способов лечения карциноматоза до последнего времени не существовало в принципе, известные нам методики были бессильны.
Так, например, лучевая терапия вообще не применяется для лечения карциноматоза из-за риска серьезных осложнений после облучения такой большой области.
Системная химиотерапия также практически бесполезна из-за особенностей опухолевых очагов при карциноматозе.
Даже хирургическое лечение не дает нужных результатов, т.к. хирург просто не способен увидеть все метастазы на поверхности брюшины, а также не ко всем из них возможен доступ. При этом достаточно единичных раковых клеток для быстрого рецидива в течение 2-3 месяцев.
Таким образом пациент с карциноматозом признавался неизлечимым, а прогнозы по продолжительности его жизни не превышали полугода.
Сегодня благодаря гипертермической внутрибрюшной химиотерапии HIPEC нам удается увеличивать 5-летнюю выживаемость до 50%, а иногда и добиваться полного излечения пациента. Прогноз выживаемости во многом зависит от локализации опухоли, например, при раке яичников или аппендикса он несколько выше, чем при колоректальном раке.
В России гипертермическая внутрибрюшная химиотерапия HIPEC применяется пока слишком мало по причине высокой стоимости процедуры и оборудования для ее проведения, а также отсутствия врачей, освоивших ее. К сожалению, многие из них даже не слышали о HIPEC, тогда как онкологам многих других стран удается добиваться отличных результатов лечения благодаря применению этой методики.
Что такое HIPEC?
Методика HIPEC направлена на точечную борьбу с раковыми клетками в брюшной полости за счет обработки подогретым раствором из химиопрепаратов. Процедура выполняется во время циторедуктивного хирургического вмешательства.
Важнейшая задача HIPEC – уничтожить максимальное количество раковых клеток, которые могут спровоцировать рецидив. Хирург не способен удалить все очаги болезни, но грамотно проведенная гипертермическая внутрибрюшная химиотерапия обеспечит наиболее масштабное устранение онкоклеток, а значит позволит значительно увеличить продолжительность жизни и сократить число рецидивов.
Паллиативные операции в онкологии
Паллиативными называют такие операции, которые направлены на улучшение качества жизни больного, уменьшение болей и других мучительных симптомов. В отличие от радикальных хирургических вмешательств, они не избавляют от рака, а лишь помогают улучшить состояние. Согласно мировой статистике, 10–20% всех операций в онкологии носят паллиативный характер. В зависимости от целей, они бывают циторедуктивными (паллиативная резекция), симптоматическими, санационными. Реконструктивно-пластические операции и биопсию тоже можно рассматривать как разновидности паллиативной хирургии. Основные цели паллиативных операций в онкологии:
В каких случаях при онкологических заболеваниях нужны паллиативные операции?
Классически основу паллиативной помощи в онкологии составляет лучевая терапия и химиотерапия. К паллиативной хирургии прибегают не так часто, но в последнее время показания расширяются. Появляются новые малоинвазивные вмешательства. Решение о проведении паллиативной операции нужно принимать индивидуально, врач должен хорошо взвесить все за и против. Важно понимать, насколько большую пользу принесет пациенту вмешательство, поможет ли повысить качество и продолжительность жизни, надолго облегчить симптомы. В то же время, необходимо правильно оценить возможные риски. Принимая решение, врач учитывает тип и стадию опухоли, количество и расположение очагов в организме, возраст и состояние здоровья пациента, прогнозируемую продолжительность жизни и другие факторы. Важен междисциплинарный подход. С пациентом должны работать врачи разных специальностей: хирург, химиотерапевт, врач лучевой терапии, другие профильные специалисты. Иногда операция является не единственным выходом. Возможно, того же эффекта удастся достичь другими, более безопасными, способами. Когда разные специалисты работают в тесном сотрудничестве, вместе им проще принять правильное решение, выбрать оптимальную лечебную тактику.
Циторедуктивные операции
В случае, когда невозможно радикальное удаление опухоли, хирург может постараться удалить как можно большую ее часть. Такие операции называются циторедуктивными. Они могут решать две задачи:
Характерный пример циторедуктивной операции — хирургическое лечение при раке яичников, осложненном канцероматозом (поражением раковыми клетками) брюшины и асцитом (скоплением жидкости в брюшной полости), когда есть риск обструкции кишечника. Удаление максимального объема опухолевой ткани в таких случаях помогает не только улучшить состояние пациента, но и увеличить выживаемость. Зачастую циторедуктивные операции проводят как часть комбинированного лечения рака. После хирургического вмешательства назначают курс химиотерапии или лучевой терапии. Эти методы лечения работают более эффективно после того, как удален основной объем опухоли.
Один из наглядных современных примеров сочетания паллиативной хирургии и медикаментозного лечения — HIPEC, гипертермическая интраперитонеальная химиотерапия. Ее применяют при раке, осложнившемся канцероматозом брюшины.
В некоторых случаях удается добиться ремиссии. Нередко вопрос о паллиативном циторедуктивном вмешательстве встает, когда есть риск серьезных, опасных для жизни осложнений, например, перфорации кишечника, сильного кровотечения. Операция помогает их предотвратить.
Симптоматические операции
Симптоматические паллиативные вмешательства направлены на борьбу с теми или иными симптомами, вызванными злокачественной опухолью. Вот некоторые примеры:
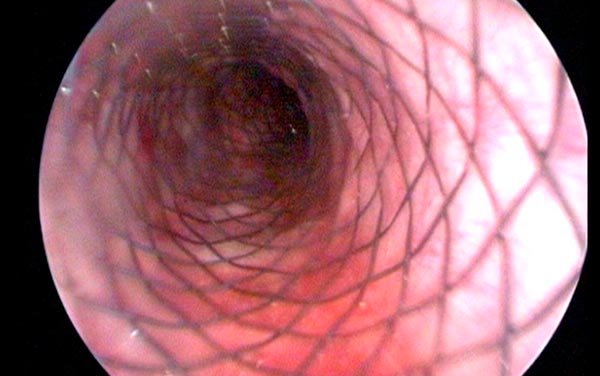
Стентирование при онкологических заболеваниях
При непроходимости полых органов, вызванной опухолевыми процессами, устанавливают стенты — полые цилиндрические каркасы с сетчатой стенкой из металла или полимерного материала. Зачастую стент можно установить эндоскопически, для этого не нужно делать разрез. Он расширяет просвет полого органа и восстанавливает его проходимость. Стенты можно устанавливать в кишечник, желудок, пищевод, мочеточники, желчные протоки, верхнюю полую вену и др. Это менее инвазивное вмешательство, по сравнению, например, с наложением обходного анастомоза, оно лучше переносится пациентами.
Санационные операции
Распадающаяся опухолевая ткань может инфицироваться. При этом ухудшается состояние больного, возникает риск распространения инфекции в организме. Для того чтобы это предотвратить, нужно удалить как можно большее количество инфицированной опухолевой ткани. Такие паллиативные операции в онкологии называются санационными. Их выполняют, например, при раке молочной железы.