хлорид натрия в бытовой химии что это
Хлорид натрия — важнейший химический реактив
Хлорид натрия составляет основу поваренной соли, самой популярной приправы 
Свойства хлорида натрия
NaCl представляет собой кристаллы с кубической ионной решеткой. Кристаллы без цвета и запаха, с четко выраженным соленым вкусом. Хлористый натрий водорастворим, не гигроскопичен. Растворяется в аммиаке, этиловом и метиловом спирте, муравьиной кислоте, глицерине, этиленгликоле. Не растворяется в ацетоне, соляной кислоте, диэтиловом эфире.
Водный раствор хлорида натрия замерзает при температуре ниже нуля. Благодаря этому свойству химреактив довольно долго использовался в качестве антигололедного средства на дорогах и тротуарах (сейчас этот способ считается экологически вредным и применяется все реже). На этом же свойстве основано применение смеси мелко наколотого льда и поваренной соли в качестве эффективного и простого охладителя, способного понизить температуру смеси на пару десятков градусов.
Хлорид натрия в природе и жизни человека

В природе хлористый натрий встречается в морской воде, соленых озерах, в соляных подземных водах, в ископаемом виде (галит, каменная соль). Галит — это минеральная форма NaCl. Иногда галит называют каменной солью, но это неверно. Каменная соль — это осадочная порода, содержащая 90% галита и примеси железа, гипса, магнезита, талька, битумов, соединений калия, кальция, магния, йода, брома, бора. Каждое месторождение каменной соли имеет свой уникальный состав.
Морская соль, получаемая выпариванием морской воды, содержит больше жизненно важных для человека примесей химических элементов, минералов и солей, чем каменная соль. В ней только 77,8% хлористого натрия. Она имеет горьковатый вкус, используется, преимущественно, в медицине и кулинарии.
Применение NaCl
— Химреактив применяется для производства более полутора тысяч веществ 
— Поваренная соль — готовый продукт, на 97 и более процентов состоящий из NaCl, используется в пищевой промышленности. Чем выше содержание хлорида натрия, тем выше сорт соли. Выпускаются также специализированные сорта с добавками микроэлементов, например, иодированная соль. Пищевая соль применяется как приправа в пищу, в качестве консерванта.
— В промышленной и полупромышленной водоподготовке для регенерации ионообменных смол в натрий-катионитовых фильтрах.
— Растворы хлорида натрия востребованы в медицине для приготовления и разведения лекарственных средств, для восстановления водно-солевого баланса организма, при кровотечениях, в качестве антидота при отравлении нитратом серебра, как антибактериальное средство для обработки ран, для некоторых других целей.
— В зоологии — для добавки в рацион животных.
Магазин «ПраймКемикалсГрупп» предлагает по хорошей цене купить поваренную соль оптом и в розницу. Также у нас широко представлены другие реактивы для лабораторных исследований и промышленности, лабораторная посуда и приборы.
Хлорид натрия: способы получения и химические свойства
Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
NaCl + AgNO3 = NaNO3 + AgCl↓
Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Хлорид натрия – это. Основные сферы применения
Хлорид натрия (хлористый натрий, столовая/пищевая/поваренная/каменная соль, галит) – это натриевая соль хлороводородной кислоты. Входит в состав поваренной соли как главный компонент, поэтому привычно ее названием в быту и именуется. В больших объемах присутствует в морской воде и является предусловием ее соленого вкуса. Также в природных условиях находится как минерал галит (каменная соль).
Свойства
В чистом виде данная соль выглядит как не имеющая цвета сыпучая кристаллическая масса (кристаллам характерна кубическая сингония) с соленым вкусом. Привкус и запах, как правило, отсутствуют. Если сочетается с какими-либо примесями, может иметь различные оттенки: голубоватый, лиловый, розовый, желтоватый или сероватый.
В воде растворяется умеренно: 35-40 г/100 мл, зависимо от температуры (сильно температура на процесс не влияет, но все же, чем выше t, тем немного лучше растворение). На растворимости могут значительно отражаться (снижать ее) хлористый водород, каустическая сода, соли – хлориды металлов. Кроме того, данное вещество подлежит достаточному растворению в нитриде водорода (21,5 г/100 мл), вступает в обменные реакции. А вот в метиловом спирте растворяется очень слабо (1,49 г/100 мл).
Если рассматривать чистый натрий хлористый, то он не является гигроскопичным. Однако в его составе часто присутствуют различные примеси, что подвергает материал сырению при нахождении на воздухе. К тому же, он образует кристаллогидрат при t до 0,15 °C.
Молярная масса – 58,44277 г/моль, плотность – 2,165 г/см³. Термосвойства: t плавления – 800,8 °C, t кипения – 1465 °C. Формула: NaCl.
Среди важных химических свойств данного материала:
— выделение хлористого водорода при воздействии серной кислоты;
— образование белого осадка хлористого серебра при сочетании с раствором азотнокислого серебра (качественная реакция на хлорид-ион);
— формирование тетрахлоркупрата натрия при компонировании с сернокислой медью (с приобретением раствором зеленой окраски вместо синей);
— практически абсолютная диссоциация в водном растворе на ионы, определяющая хим. свойства вещества свойствами катионов натрия и хлорид-анионов.
Нахождение в природе, промышленное и лабораторное получение
Как уже было сказано, в естественной среде натрий хлористый присутствует в виде минерала галита, образующего залежи каменной соли в осадочных горных породах, участки на побережьях соленых водоемов, соляные корки на солончаковых почвах. Обнаруживается он и на стенках вулканических кратеров, и в сольфатарах.
Просто невероятные объемы этого соединения находятся в морской воде, из каждой тонны которой можно получить 1,3 кг NaCl. Но и это еще не все. Брызги морской воды испаряются, таким образом хлорид натрия попадает в атмосферу. Если взять облако на высоте 1,5 км, то треть его капель, размер которых превышает 10 мкм, имеет в своем составе соль. А еще она присутствует в кристаллах снега.
Галит – минерал с плотностью 2,1-2, 2 г/см³, и твердостью по шкале Мооса 2 – не имеет окраса, его текстура прозрачна, дополнительно характерен стеклянный отблеск.
Каменная соль – осадочная горная порода, эвапорит, в составе которой галита содержится больше 90 %. Поэтому часто эти названия применяются как синонимические между собой, а следовательно и с хлоридом натрия. Каменная соль может быть снежно-белой или не иметь никакого цвета. Но в большинстве случаев ей присущ какой-либо оттенок, в зависимости от примесей: глина и тальк дают сероватый окрас, оксиды и гидроксиды железа – желтый, апельсиновый, розовый, красный, битумы – коричневый.
Современное производство пищевой соли – это полностью механизированный и автоматизированный процесс. Массовое изготовление этого продукта выглядит как выпаривание морской воды, рассолов соляных источников, разработка соляных шахт или, собственно, добыча каменной соли. Среди самых крупных стран-производителей: Китай, США, Германия, Индия и Канада.
Что касается лабораторного синтеза, то необходимости в нем, как и в пром. производстве, нет. Это закономерно объясняется значительными природными запасами указанного вещества. Все же, лабораторное получение возможно. Хлорид натрия может быть синтезирован в качестве основного или побочного продукта следующими способами:
— экзотермическая реакция при использовании совокупности простых веществ Na + Cl;
— нейтрализация самой распространенной щелочи (каустической соды NaOH) с помощью хлористого водорода (HCl).
Хлорид натрия: применение
Данный материал нашел широчайшее применение в разноплановых сферах и процессах. Рассмотрим основные из них.
Пищепром
Здесь всем известная пищевая/поваренная соль вводится в огромный перечень продуктов питания. Она должна быть чистой не менее чем на 97 %. Может служить вкусовой добавкой и задействоваться при консервировании. В зависимости от происхождения, может называться каменной или морской, а согласно входящим в ее состав добавкам – йодированной, фторированной и т.д. Все разновидности, кроме йодированной соли, не должны иметь посторонних примесей, появление которых не связано с добыванием продукта.
Помним, что хлорид натрия – главный ингредиент поваренной соли, но не единственный. Кроме него, в составе могут присутствовать в незначительных объемах соли кальция, магния и калия. По их части – придание гигроскопичности и жесткости. Поэтому чем их меньше, тем качество соли выше.
Количество хлористого натрия в соли определяет ее сорт:
— экстра – не меньше 99,5 %;
Хлорид натрия – важнейшая приправа в кулинарии. Приправа со специфическим вкусом, без которой еда человеку кажется пресной и безвкусной. Все – в связи с человеческой физиологией. Но часто употребление соли людьми куда больше, нежели того требует организм.
Медицина
В медицинской сфере находят применение растворы хлорида натрия с различной концентрацией, а именно:
— изотонический (0,9 %). Служит детоксицирующим средством. Помогает корректировать состояние систем организма при обезвоживании. Используется для растворения иных лекарств и выступает инфузионной средой;
— гипертонический (1 % и больше, как правило, 3,5 % и 10 %). Выступает вспомогательным осмодиуретиком при отеках головного мозга. Способствует повышению давления в случае кровотечений. Помогает при дефиците ионов натрия и хлора в организме, а также при интоксикациях азотнокислым серебром. Подходит для местной обработки гнойных раневых поверхностей (раствор способствует выделению гноя, осуществляет противомикробное воздействие). В офтальмологии используется в качестве противоотечного препарата. Зависимо от выполняемой задачи, может вводиться внутривенно или использоваться наружно;
— гипотонический (до 0,85 %). Раствор с более низким осмотическим давлением, по сравнению с нормальным π плазмы крови.
Казалось бы, разница в концентрациях незначительная. Но использовать один раствор там, где показан другой, нельзя. Последствия могут быть плачевными.
В целом, хлористый натрий необходим при обезвоживании, если организм потерял большое количество жидкости, в случае инфекций и при других не менее серьезных проблемах, поэтому его значение для здоровья и жизни человека переоценить сложно.
— наружный (0,5-2 % растворы для ванны, душа, полосканий, клизм, ингаляций);
— парентеральный (под кожу или внутрь вены, если речь идет об изотоническом растворе, исключительно внутривенно – если о гипертоническом).
Запомните: вводить гипертонический раствор под кожу запрещено, иначе в месте инъекции будет развиваться необратимый некроз.
Косметология
Хлорид натрия важен не только для преимущественного числа тканей и жидкостей человеческого организма. Сложно переоценить его значение и для нашей с вами красоты. Он принимает участие в различных физиологических процессах, транспортирует питательные компоненты, задействуется в детоксикации, налаживает функционирование нервной системы и поддерживает оптимальный водно-электролитный баланс. Все это не может не отражаться положительно на внешнем виде.
Данную субстанцию вводят и в домашнюю косметику, и в продукты промышленного изготовления. Его можно встретить в составе многих косметических средств и средств личной гигиены: скрабов, шампуней, композиций для стайлинга, ополаскивателей для ротовой полости, средств для лечебных ножных ванн. Декоративная косметика, к слову – не исключение. Это, главным образом, тональные кремы, основы и пудры.
Иногда он выступает вспомогательным компонентом, а иногда служит эксфолиантом, вкусоусилителем, увеличивающей вязкость добавкой и даже антисептиком. Кстати, роль загустителя, пожалуй, одна из самых распространенных при изготовлении косметики. Соль сгущает водные фазы шампуней, гелей для душа, очистительных композиций для лица. В скрабах и гоммажах выступает абразивом.
Стоит отметить, что натрий хлористый является важным компонентом многих формул, в функциональных обязанностях которых – выполнение самых разных предназначений. Особого внимания заслуживает формула «Кротеин», состоящая из соли и аминокислоты кератина. Соль, меняя осмодавление, помогает кератину проходить внутрь волоса, тем самым укреплять его и увеличивать пластичность. Эта же формула подходит для того, чтобы кондиционировать ногти и кутикулу.
Итак, задач, с которыми данное вещество в составе различных косметических средств справляется на ура, немало. Это, прежде всего, такие:
— отшелушивание кожи, очищение от загрязнений и отмерших клеток, выравнивание тона, структуры и регенерация;
— подсушивание кожных покровов, положительное воздействие при избытке себорегуляции, благодаря мягким вяжущим свойствам;
— избавление от шероховатости, ороговевших участков, неэстетичных «пупырышек» при фолликулярном кератозе;
— усиление защитной функции кожи путем повышения прочностных характеристик верхних слоев эпидермиса;
— снятие воспалений и заживление повреждений (но только незначительных);
— устранение зуда, в частности и спровоцированного укусами паразитов.
Имеет ли этот продукт противопоказания? Его наружное применение сопровождается абсолютной безопасностью и противопоказаний не имеет.
Ветеринария
Данный препарат является главным источником для формирования хлороводородной кислоты желудочного сока. При внутреннем приеме он отлично всасывается из ЖКТ, а при внутреннем введении расходится по кровеносной системе, избирательно воздействуя на ткани и органы.
Здесь, как и в медицине, используют изотонический, гипертонический и гипотонический растворы. Каждый – для определенных задач.
Химическая отрасль
В этом направлении соль применяют при создании различных материалов, в частности таких, как карбонат натрия, газообразный хлор, едкий натр, хлорная известь, натрий сернокислый и металлический, соляная кислота и др. Она вместе с каменным углем, известняками и серой формирует «большую четверку» важнейшего для хим. промышленности минерального сырья.
К тому же, каменная соль используется в пром. получении легкорастворимого в воде хлорноватокислого натрия – эффективного средства для борьбы с сорняками (популярного гербицида).
Коммунальные хозяйства
Без технического хлорида натрия не обходятся и в этом направлении. Им в зимний период посыпают дороги, чтобы минимизировать обледенение. Для этой цели берут не само вещество, а в сочетании с песком, глиной, щебнем или с другими солями. Это экономный способ борьбы с гололедом. Хлористым натрием в качестве антифриза, ускоряющего таяние льда, посыпают, кстати, не только дороги, но и тротуары. Хотя переусердствовать в этом плане нельзя, поскольку, ввиду возможной коррозии, не исключено негативное воздействие на кожаную обувь и техническое состояние автомобилей. Негатив ощутить могут также животные.
Другие сферы применения:
— водоподготовка (уменьшение жесткости воды в качестве натрий-катионитовых фильтров);
— кожевенное производство (обработка меха и кожи);
Как видите, обычная поваренная соль не такая уж и простая. Ей под силу выполнять различные задачи в большом перечне отраслей. Она эффективна и доступна. И это лишь главные, но далеко не единственные преимущества продукта, что и объясняет немалую широту его применения.
Журнал «Сырье и Упаковка»
Текущий номер
Ближайшие выставки
Партнеры
Гипохлориты и их применение в средствах бытовой химии
30.03.2020
| Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск |
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO) 2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl 2 ) в результате взаимодействия оксида марганца(IV) MnO 2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl 2 + H 2 O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl 2 + K 2 СO 3 = 2KHCO 3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H 2 O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H 2 O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO) 2 ×2H 2 O, Ca(ClO) 2 ×3H 2 O, Ca(ClO) 2 ×4H 2 O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10 –8 при 20°С.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН 7,58 существуют преимущественно гипохлорит-ионы.
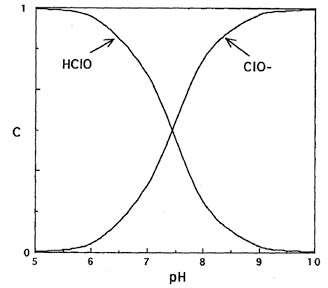
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O 2 ↑ и 2Сa(ClO) 2 = СaCl 2 + O 2 ↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl 2 ↑ + O 2 ↑ + 2H 2 O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl 2 ↑ + H 2 O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO – + CO 2 + H 2 O = HCO 3 – + HClO.
В слабокислых и нейтральных средах при 3 2 ↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
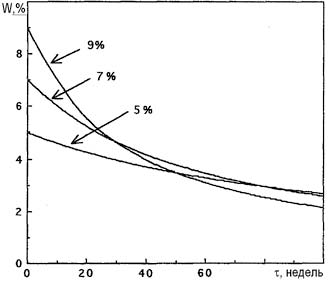
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).

Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
2HClO + 2H + + 2e – = Cl 2 ↑ + 2H 2 O, E° = 1,630 В,
HClO + H + + 2e – = Cl – + H 2 O, E° = 1,500 В.
в нейтральной и щелочной среде
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H + + ClO – + Cl – = Cl 2 ↑ + H 2 O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Существуют две производственные схемы данного метода:
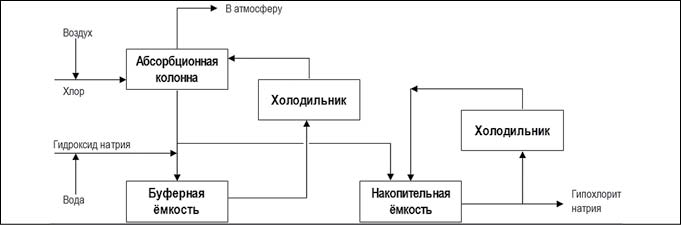
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
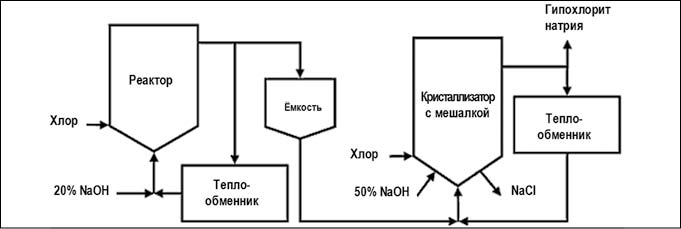
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76