Гзт что это микробиология
Гзт что это микробиология
Реакции гиперчувствительности IV типа также называют гиперчувствительность замедленного типа (ГЗТ). Они обусловлены клеточными иммунными реакциями. В отличие от реакций немедленного типа, они развиваются не ранее чем через 24-48 ч после повторного введения Аг. Развитие реакций гиперчувствительности замедленного типа (ГЗТ) индуцируют продукты микроорганизмов и гельминтов, природные и неприродные Аг и гаптены (лекарства, косметические красители).
Классические примеры гиперчувствительности замедленного типа (ГЗТ) — туберкулиновая проба и контактный дерматит. Распознавание Аг, связанного с белками организма, иммунокомпетентными клетками вызывает активацию Т-хелперов, что приводит к клональной пролиферации Т-эффекторов ГЗТ. Сенсибилизированные лимфоциты секретируют цитокины, привлекающие другие лимфоциты и макрофаги в очаг аллергической реакции. На более поздних этапах в реакцию включаются полиморфно-ядерные фагоциты, стимулирующие воспалительный ответ.
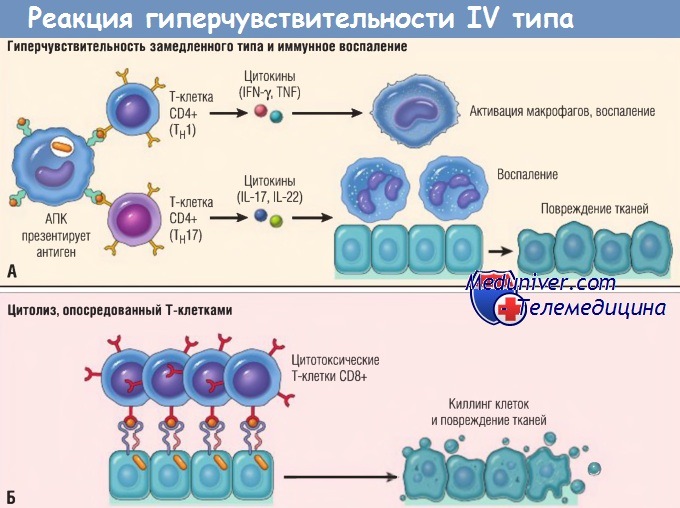
(А) В реакциях гиперчувствительности замедленного типа Тн1-клетки CD4+ (а иногда Т-клетки CD8+, не показаны) отвечают на тканевые антигены секрецией цитокинов,
которые стимулируют воспаление и активируют фагоцитоз, приводя к повреждениям тканей. Тн17-клетки CD4+ способствуют воспалению, мобилизуя нейтрофилы (в меньшей степени моноциты).
(Б) При некоторых заболеваниях цитотоксические Т-клетки CD8+ непосредственно убивают клетки тканей.
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли; АПК — антигенпрезентирующая клетка.
• Гаптены приобретают способность инициировать реакции гиперчувствительности замедленного типа (ГЗТ) после взаимодействия с высокомолекулярными соединениями, в частности с белками. В свою очередь белки вызывают гиперчувствительность замедленного типа (ГЗТ) при длительной иммунизации малыми дозами в сочетании с адъювантами. Многие низкомолекулярные органические вещества или неорганические вещества (например, хром), связываясь с белками кожи, выполняют роль гаптенов и сенсибилизируют организм при длительном контакте. В результате развивается контактная аллергия, клинически проявляющаяся контактными дерматитами.
• Способность отвечать развитием гиперчувствительности замедленного типа (ГЗТ) на различные микробные продукты (например, Аг возбудителей туберкулёза, бруцеллёза) применяют при постановке кожных проб для диагностики инфекционного процесса или установления возможного контакта организма с возбудителем.
Лекция № 14. Аллергия. ГНТ, ГЗТ. Особенности развития, методы диагностики. Иммунологическая толерантность



Классификация Джелла и Кумбса выделяет 4 основных типа гиперчувствительности в зависимости от преобладающих механизмов, участвующих в их реализации.
Аллергические реакции гуморального (немедленного) типа обусловлены главным образом функцией антител классов IgG и особенно IgE (реагинов). В них принимают участие тучные клетки, эозинофилы, базофилы, тромбоциты. ГНТ делят на три типа. По классификации Джелла и Кумбса к ГНТ относятся реакции гиперчувствительности 1, 2 и 3 типов, т.е. анафилактическая (атопическая), цитотоксическая и иммунных комплексов.
ГНТ характеризуется быстрым развитием после контакта с аллергеном (минуты), в ней участвуют антитела.
Иммунологическая толерантность — специфическое подавление иммунного ответа, вызванное предварительным введением антигена. Иммунологическая толерантность как форма иммунного ответа специфична.
Толерантность может проявляться в подавлении синтеза антител и гиперчувствительности замедленного типа (специфического гуморального и клеточного ответа) или отдельных видов и типов иммунного ответа. Толерантность может быть полной (нет иммунного ответа) или частичной (существенное снижение ответа).
В основе индуцированной иммунологической толерантности лежат различные механизмы, среди которых принято выделять центральные и периферические.
Центральные механизмы связаны с непосредственным воздействием на иммунокомпетентные клетки. Основные механизмы:
— блокада эффекторных клеток;
— дефектность презентации антигенов, дисбаланс процессов пролиферации и дифференциации, кооперации клеток в иммунном ответе.
Исторически иммунологическую толерантность рассматривают как защиту против аутоиммунных заболеваний. При нарушении толерантности к собственным антигенам могут развиваться аутоиммунные реакции, в том числе возникать аутоиммунные заболевания (ревматоидный артрит, системная красная волчанка).
Основные механизмы отмены толерантности и развития аутоиммунных реакций
3. Появление новых антигенных детерминант в результате связывания чужеродных антигенных детерминант с клетками хозяина.
4. Нарушение гистогематических барьеров.
5. Действие суперантигенов.
Гзт что это микробиология
Гиперчувствительность клеточного типа лежит в основе развития ряда инфекционных заболеваний (туберкулеза, бруцеллеза, сальмонеллеза, дифтерии, герпеса, кори, грибковой инфекции), трансплантационного иммунитета, противоопухолевого иммунитета, аутоиммунных заболеваний, контактного дерматита.
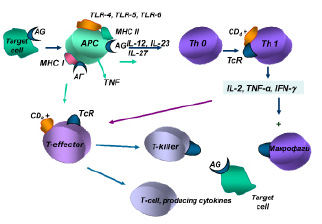
Взаимодействие антигенов-аллергенов с антигенпрезентирующими клетками обеспечивается при участии Tool-рецепторов (TLR4, TLR5, TLR6, TLR62), экспрессируемых на их мембранах.
В механизмах индукции гиперчувствительности IV типа важная роль отводится антигенпрезентирующим макрофагам, дендритным и другим клеткам, обеспечивающим фагоцитирование и комплексирование негидролизованной части антигена-аллергена с белками II класса молекул МНС, а также презентацию антигена комплементарному клону Тh0. Одновременно антигенпрезентирующие клетки продуцируют цитокины (IL-12, IL-23, IL-27), обеспечивающие пролиферацию и дифференцировку антигенчувствительных клонов Th1.
Полагают, что главным цитокином в реакциях IV типа является гамма-интерферон, продуцируемый Тh1, который вызывает активацию макрофагов, вовлечение их в иммунный ответ за счет их фагоцитарной активности и уничтожения клеток-мишеней в процессе фагоцитоза, а также за счет усиления продукции монокинов с полимодальной направленностью действия.
Интерлейкин-2, продуцируемый Тh1, обеспечивает аутокринную активацию этих клеток лимфоцитов и паракринную неспецифическую пролиферацию Т-эффекторов. Антигенстимулированные Т-лимфоциты-хелперы и Т-лимфоциты-эффекторы обеспечивают продукцию медиаторов аллергии клеточного или замедленного типа, получивших название лимфокинов (рисунок).
Индукция иммунного ответа при клеточно-опосредованных реакциях
В настоящее время выделено несколько десятков лимфокинов, которые в соответствии с особенностями их биологического действия могут быть разделены на следующие группы:
1. Факторы, влияющие на лимфоциты (фактор переноса Лоуренса, митогенный фактор, фактор, стимулирующий Т- и В-лимфоциты).
2. Факторы, влияющие на макрофаги (миграцию ингибирующий фактор; фактор, активирующий макрофаги; фактор, усиливающий пролиферацию макрофагов).
3. Цитотоксические факторы (лимфотоксин; фактор, тормозящий синтез ДНК; фактор, ингибирующий гемопоэтические стволовые клетки).
4. Факторы хемотаксиса макрофагов, нейтрофилов, лимфоцитов и эозинофилов.
5. Антивирусные и антимикробные факторы.
Многие лимфокины обладают дистантным биологическим эффектом.
Цитотоксические CD8-Т-лимфоциты оказывают прямое действие. CD8-Т-лимфоциты обеспечивают развитие цитолиза клетки-мишени, на мембране которой фиксирован антиген, в три стадии:
I стадия – двойного распознавания антигена в комплексе с белками МНС I класса, экспрессированными на клетке-мишени.
II стадия – летального удара возникает в процессе контакта Т-лимфоцита-эффектора с клеткой-мишенью при участии белка перфорина, лимфотоксина или индуктора апоптоза, получаемых клеткой мишенью при межклеточном контакте.
III стадия – стадия коллоидно-осмотического лизиса, возникающего вслед за перфорацией мембраны и пассивной диффузией ионов, а затем и высокомолекулярных соединений по осмотическому градиенту через поврежденную мембрану.
Описание отдельных форм аллергических реакций
Контактные дерматиты. Аллергия этого типа чаще возникает к низкомолекулярным веществам органического и неорганического происхождения: различным химическим веществам, краскам, лакам, косметическим препаратам, антибиотикам, пестицидам, соединениям мышьяка, кобальта, платины, воздействующим на кожу. Контактные дерматиты могут вызывать также вещества растительного происхождения – семена хлопка, цитрусовые. Аллергены, проникая в кожу, образуют стабильные ковалентные связи с SH- и NН2-группами протеинов кожи. Эти конъюгаты обладают сенсибилизирующими свойствами.
Сенсибилизация обычно возникает в результате длительного контакта с аллергеном. При контактных дерматитах патологические изменения наблюдаются в поверхностных слоях кожи. Отмечаются инфильтрация воспалительными клеточными элементами, дегенерация и отслойка эпидермиса, нарушение целостности базальной мембраны.
Морфологические изменения при контактных дерматитах обусловлены фазным характером инфильтрации. Через 2-3 часа после инъекции антигена-аллергена возникает инфильтрация тканей сегментоядерными нейтрофилами. Через 5-6 часов в периваскулярной области появляются моноциты. Через 8 часов инфильтрация моноцитами становится интенсивной. К 24–72 часам она уменьшается. Клеточные элементы, содержащиеся в очаге воспаления, представлены в основном лимфоцитами и макрофагами.
Инфекционная аллергия. ГЗТ развивается при хронических бактериальных, вызванных грибами и вирусами инфекциях (туберкулезе, бруцеллезе, туляремии, сифилисе, бронхиальной астме, стрептококковой, стафилококковой и пневмококковой инфекциях, аспергиллезе, бластомикозе), а также при заболеваниях, вызываемых простейшими (токсоплазмоз), при глистных инвазиях.
Сенсибилизация к микробным антигенам обычно развивается при воспалении. Не исключена возможность сенсибилизации организма некоторыми представителями нормальной микрофлоры (нейссерии, кишечная палочка) или патогенными микробами при их носительстве.
Сенсибилизация к микробным антигенам в определенных условиях благоприятствует ликвидации патологического процесса. Одним из механизмов повышения устойчивости при ГЗТ может служить повышение неспецифической резистентности (усиление метаболической активности и фагоцитарной способности макрофагов, повышение активности лизоцима).
Отторжение трансплантата. При трансплантации организм реципиента распознает чужеродные трансплантационные антигены (антигены гистосовместимости) и осуществляет иммунные реакции, ведущие к отторжению трансплантата. Антигены главного комплекса гистосовместимости I класса локусов А, В и С есть на всех ядросодержащих клетках, а локуса G – лишь на трофобласте. Эти антигены распознаются CD8-лимфоцитами.
Антигены ГКГС II класса локусов DR, DP, DQ экспрессированы на лимфоидных, макрофагальных и эндотелиальных клетках. Они распознаются CD4-лимфоцитами.
Кроме того, на эритроцитах имеются антигены системы АВО и Rh, в почках – системы АВО. Названные антигены тоже играют определенную роль в индукции отторжения трансплантата.
Виды трансплантатов. Различают сингенные, аллогенные и ксеногенные трансплантаты.
Аллогенные и ксеногенные трансплантаты без применения иммуносупрессивной терапии отторгаются. Несмотря на появление новых, более селективных в отношении трансплантационного иммунитета иммуносупрессоров – грибковых макролидных антибиотиков (циклоспорины, FK506, рапамицин) проблема иммунологического конфликта трансплантата и реципиента еще не решена.
Механизмы отторжения трансплантата. При отторжении трансплантата наблюдается как гуморальный, так и клеточный иммунный ответ, в частности, механизмы ГЗТ, цитотоксические и иммунокомплексные реакции.
В зависимости от сроков отторжение трансплантата может быть сверхострым, острым и хроническим. Сверхострое отторжение возможно при наличии предсуществующих антител, то есть при повторной пересадке тканей от одного и того же донора, и происходит в течение первых 5 дней, а иногда в первые минуты и часы.
При остром отторжении предсуществующих антител нет. Острое отторжение – это классический вариант отторжения, в основе которого лежат как гуморальные, так и клеточные механизмы. Такой вариант отторжения наблюдается при отсутствии или прекращении иммуносупрессирующей терапии. Начало острого отторжения может быть отложено на несколько недель или даже месяцы, но начавшись, процесс заканчивается за несколько дней.
Отторжение считается хроническим, если в случае погрешностей в проведении иммуносупрессирующей терапии наблюдаются повторные эпизоды начинающегося отторжения трансплантата. В основе такого отторжения также лежат реакции гуморального и клеточного иммунитета. Острое и хроническое отторжение отличаются исходом – степенью облитерации сосудов.
Наиболее активны, как стимуляторы отторжения, ФНО и γ-ИФН, которые не только угнетают жизнедеятельность клеток трансплантата и активируют эффекторы цитотоксичности, но и усиливают экспрессию трансплантационных антигенов на клетках, вовлекая цитотоксические эффекторы. При отторжении активны цитотоксические CD4-положительные лимфоциты, их роль даже более значительна, чем CD8-киллеров.
При аллотрансплантации кожи, костного мозга, почки образуются гемагглютинины, гемолизины, лейкотоксины и антитела к лейкоцитам и тромбоцитам. При реакции антиген-антитело образуются биологически активные вещества, повышающие проницаемость сосудов, что облегчает миграцию Т-киллеров в пересаженную ткань. Лизис эндотелиальных клеток в сосудах трансплантата приводит к активации процессов свертывания крови. Кроме того, происходит активация различных фракций комплемента:
• хемотаксические фракции – привлекают полиморфноядерные лейкоциты, которые разрушают трансплантат с помощью лизосомальных ферментов;
• С6 компонент комплемента – активирует свертывающую систему крови;
• С3b фракция – вызывает агрегацию тромбоцитов.
Активация гуморального ответа в виде иммунокомплексных реакций приводит к возникновению васкулита, тромбоза и ишемического некроза.
γ-ИФН привлекает макрофаги, которые также выделяют цитотоксические факторы.
При отторжении по первичному типу участвуют в основном мононуклеары и лишь немного полиморфноядерных гранулоцитов, при отторжении по вторичному типу в качестве эффекторов выступают и мононуклеары, и полиморфноядерные гранулоциты.
Аутоиммунные заболевания. Развитие аутоиммунных заболеваний обусловлено сложным взаимодействием аллергических реакций клеточного и гуморального типа с преобладанием той или иной реакции в зависимости от характера аутоиммунного заболевания.
Аутоиммунные болезни представляют собой гетерогенную группу заболеваний, развитие которых связано или с доминирующей ролью цитолитических антител в механизмах деструкции клеток, или сочетанное патогенное воздействие на клетки-мишени CD8+-Т-лимфоцитов-киллеров, продуцентов лимфокинов с цитолитическими органоспецифическими или неспецифическими антителами.
Преимущественный цитотоксический эффект комплементсвязующих органоспецифических антител имеет место при аутоиммунных гемолитических анемиях, лейкопениях, тромбоцитопениях, тиреоидите Хашимото, пернициозной анемии, болезни Аддисона и других.
Между тем, в патогенезе системной и дискоидной красной волчанки, ревматоидного артрита, дерматомиозита, склеродермии, синдрома Шегрена и других форм патологии, ранее именуемых коллагенозами, ведущая роль в развитии воспалительно-деструктивных процессов в тканях отводится клеточному иммунитету. При этом антителозависимый и комплементзависимый цитолиз, патогенное действие токсических иммунных комплексов на различные органы и ткани потенцируют клеточно-опосредованные реакции.
В индукции аутоиммунных заболеваний выделяют несколько возможных механизмов:
1. Аутоиммунные поражения могут возникать в результате срыва иммунологической толерантности к собственным неизмененным тканям. Срыв иммунологической толерантности может быть обусловлен соматическими мутациями лимфоидных клеток, что приводит либо к появлению мутантных запретных клонов Т-хелперов, обеспечивающих развитие иммунного ответа на собственные неизменные антигены. В ряде случаев возможно образование костимулирующих молекул, модифицирующих структуру МНС антигенов, воспринимаемых лимфоидной системой как генетически чужеродное образование.
2. В последние годы важная роль в развитии аутоиммунных реакций отводится Тh17, синтезирующим ряд про- и противовоспалительных цитокинов, в частности, IL-17, GCSF, TNFα, IL-6, IL-10, IL-12 и др..
3. Образование аутоантител против естественных, первичных, антигенов-аллергенов иммунологически забарьерных тканей (нервной, хрусталика, щитовидной железы, яичек, спермы). В эмбриональный период забарьерные антигены отделены от крови гистогематическими барьерами, препятствующими их контакту с иммунокомпетентными клетками. В результате к забарьерным антигенам не формируется иммунологическая толерантность. При появлении в крови забарьерных антигенов против них начинают вырабатываться аутоантитела и возникает аутоиммунное поражение.
4. Образование аутоантител против приобретенных, вторичных, антигенов, образующихся под влиянием повреждающего воздействия на органы и ткани патогенных факторов неинфекционной (тепло, холод, ионизирующее излучение) и инфекционной (микробных токсинов, вирусов, бактерий) природы.
5. Образование аутоантител против перекрестно-реагирующих или гетерогенных антигенов. Мембраны некоторых разновидностей стрептококка имеют антигенное сходство с сердечными тканевыми антигенами и антигенами базальной мембраны почечных клубочков. В связи с этим антитела к названным микроорганизмам при стрептококковых инфекциях реагируют с тканевыми антигенами сердца и почек, приводя к развитию аутоиммунного поражения.
Разделение аллергических реакций на несколько основных типов в определенной степени условно, поскольку многие антигены-аллергены, воздействующие на организм, являются комплексными и одномоментно вовлекают в иммунный ответ и В-систему лимфоцитов, и Т-лимфоциты-эффекторы.
Преобладание того или иного типа аллергических реакций в патогенезе аллергического заболевания позволяет отнести его к реакциям гуморального или клеточного типов.
Некоторые виды аутоиммунных заболеваний являются классическим примером одномоментного взаимодействия или последовательного развития аллергических реакций гуморального и клеточного типов, лежащих в основе системного или локального воспалительно-деструктивного повреждения тканей.
Гзт что это микробиология
Аллергия отличается от иммунитета тем, что сам по себе аллерген не вызывает повреждения. При Алвызывает лергии повреждение клеток и тканей комплекс аллерген-аллергическое АТ.
Классификация аллергенов: экзоаллергены и эндоаллергены.
1) инфекционные: а) бактериальные, б) вирусы, в) грибки,
2) пыльца цветущих растений, пух тополя, одуванчик, амброзия, хлопок,
3) поверхностные (или эпиаллергены),
7) продукты химического синтеза.
а) естественные (первичные): хрусталик и сетчатка глаза, ткани нервной системы, щитовидной железы, мужских половых желез,
б) вторичные (приобретенные), индуцированные из собственных тканей под влиянием внешних воздействий: инфекционные:
● промежуточные поврежденная под действием микроба+ткань;
● комплексные микроб+ткань, вирус+ткань;
● холодовые, ожоговые, при облучении;
Общая характеристика видов аллергических реакций:
Реакция немедленного типа (РНТ), B-тип
Реакция замедленного типа (РЗТ), T-тип
1) клинический синдром
анафилактический шок, аутоиммунные заболевания, отторжение трансплантата, контактный дерматит.
бронхиальная астма, крапивница, отек Квинке, мигрень, сывороточная болезнь, атопии.
1) реакция на вторичное введение
4) пассивный перенос
5) местная клеточная реакция
полинуклеарная (зудящий волдырь)
мононуклеарная (тестообразное возвышение)
6) цитотоксический эффект в культуре тканей
Общий патогенез аллергических реакций (3 стадии):
1. Иммунологическая (образование АТ),
2. Патохимическая ( выделение субстратов БАВ) и
3. Патофизиологическая (клинические проявления).
Реагиновый тип повреждения тканей (I тип):
иммунологическая стадия: Реагины своим концом Fс (constant fragment) фиксируются на соответствующих рецепторах тучных клеток и базофилов; нервных рецепторах сосудов, гладких мышцах бронхов кишечника и форменных элементах крови. Другой конец молекулы Fаb antigen-binging fragment вариабельной части выполняет антительную функцию, связываясь с АГ, причем 1 молекула IgE может связать 2 молекулы АГ. Т.к. IgE синтезируются в лимфатической ткани слизистых оболочек и лимфоузлов (пейеровы бляшки, мезентериальные и бронхиальные), поэтому при реагиновом типе повреждения шоковыми органами являются органы дыхания, кишечник, конъюнктива = атипичная форма бронхиальной астмы, поллинозы, крапивницы, пищевая и лекарственная аллергии, гельминтозы. Если в организм поступает тот же антиген, или он находится после первичного попадания, то происходит связывание его с IgE-АТ как циркулирующими, так и фиксированными на тучных клетках и базофилах [3].
Происходит активация клетки и переход процесса в патохимическую стадию. Активация тучных и базофильных клеток (дегрануляция) приводит к высвобождению различных медиаторов.
Медиаторы аллергии немедленного типа :
5. Тромбоцитактивирующие факторы.
8. Эозинофильный хемотаксический фактор анафилаксии и высокомолекулярный нейтрофильный хемотаксический фактор.
Патофизиологическая стадия. Установлено, что в основе действия медиаторов имеется приспособительное, защитное значение. Под влиянием медиаторов повышается диаметр и проницаемость мелких сосудов, усиливается хемотаксис нейтрофилов и эозинофилов, что приводит к развитию различных воспалительных реакций. Увеличение проницаемости сосудов способствует выходу в ткани иммуноглобулинов, комплемента, обеспечивающих инактивацию и элиминацию аллергена. Образующиеся медиаторы стимулируют выделение энзимов, супероксидного радикала, МДВ и др., что играет большую роль в противогельминтозной защите. Но медиаторы одновременно оказывают и повреждающее действие: повышение проницаемости микроциркуляторного русла ведет к выходу жидкости из сосудов с развитием отека и серозного воспаления с повышением содержания эозинофилов, падения артериального давления и повышения свертывания крови. Развивается бронхоспазм и спазм гладких мышц кишечника, повышение секреции желез. Все эти эффекты клинически проявляются в виде приступа бронхиальной астмы, ринита, конъюнктивита, крапивницы, отека, кожного зуда, диарреи.
Поллинозы (pollinosis от pollen пыльца): аллергический ринит и конъюнктивит, отек слизистой, слезотечение, нередко зуд на пыльцу растений.
II тип повреждения – цитотоксический: образовавшиеся к АГ клеток АТ присоединяются к клеткам и вызывают их повреждение или даже лизис, поскольку клетки организма приобретают аутоаллергенные свойства под действием различных причин, например химических веществ, чаще лекарств за счет:
1) конформационных изменений АГ клетки,
2) повреждения мембраны и появления новых АГ,
3) образования комплексных аллергенов с мембраной, в которых химическое вещество играет роль гаптена. Аналогично действуют на клетку лизосомальные ферменты фагоцитирующих клеток, бактериальные энзимы и вирусы.
Образующиеся АТ относятся к классам IgG или IgM. Они соединяются своим Fab концом с соответствующими АГ клеток. Повреждение может быть вызвано 3 путями:
2) за счет активации фагоцитоза клеток, покрытых опсонинами-антителами G4,
3) через активацию антителозависимой цитотоксичности.
После соединения с клеткой происходят конформационные изменения в области Fс конце антитела, к которому присоединяются К-клетки (киллеры Т-лимфоциты и нулевые клетки).
В патохимическую стадию активируется система комплемента (система сывороточных белков). Лизис клеток-мишеней развивается при совместном действии компонентов от С5б до С9. В процессе участвуют супероксидный анион-радикал и лизосомальные ферменты нейтрофилов.
Патофизиологическая стадия. В клинике цитотоксический тип реакции может быть одним из проявлений лекарственной аллергии в виде лейкоцитопении, тромбоцитопении, гемолитической анемии, при аллергических гемотрансфузионных реакциях, при гемолитической болезни новорожденных в связи с образованием у резус-отрицательной матери резус-положительных IgG к эритроцитам плода.
Патохимическая стадия. Под влиянием комплекса и в процессе его удаления образуется ряд медиаторов для фагоцитоза и переваривания комплекса: это комплемент, лизосомальные ферменты (кислая фосфатаза, рибонуклеаза, катепсины, коллагеназа, эластаза); кинины, вызывающие спазм гладких мышц бронхов, расширение сосудов, хемотаксис лейкоцитов, болевой эффект, повышение проницаемости микроциркуляторного русла. Так же может происходить активация фактора Хагемана (XII) и (или) плазминовой системы и выделение гистамина, серотонина, тромбоцитактивирующего фактора, вызывающего агрегацию тромбоцитов на эндотелии и выделение из тромбоцитов гистамина и серотонина.
Третий тип иммунного повреждения является ведущим в развитии сывороточной болезни, экзогенных аллергических альвеолитов, некоторых случаев лекарственной и пищевой аллергии, ряда аутоиммунных заболеваний (красная волчанка, ревматоидный артрит). При значительной активации комплемента может развиваться системная анафилаксия в виде анафилактического шока [4].
В иммунологическую стадию за 10-12 дней накапливается клон сенсибилизированных Т-лимфоцитов, в клеточную мембрану которых встроены структуры, выполняющие роль АТ, способных соединяться с соответствующим аллергеном. Лимфоцитам не нужно фиксироваться, они и есть хранилище медиаторов аллергии. При повторной аппликации аллергена Т-лимфоциты диффундируют из кровотока к месту апликации и соединяются с аллергеном. Под действием комплекса иммуно-аллерго-рецептор+аллерген лимфоциты раздражаются (патохимическая стадия) и выбрасывают медиаторы ГЗТ:
1) фактор кожной реактивности,
2) фактор бласттрансформации лимфоцитов,
4) фактор хемотаксиса,
5) фактор торможения миграции макрофагов (MIF),
8) фактор, стимулирующий образование макрофагами эндогенных пирогенов,
9) митогенные факторы.
Патогенез аутоиммунных заболеваний на эндоаллергены:
Выделяют три возможных варианта:
1) образование аутоАТ на первичные аллергены, поступающие в кровь при повреждении соответствующего органа (т.к. внутриутробно при формирования иммунной системы они не контактировали с лимфоцитами, были изолированы гисто-гематическими барьерами или развились после рождения),
2) выработка сенсибилизированных лимфоцитов против чужеродной флоры, имеющей общие специфические АГ детерминанты с тканями человека (стрептококк группы А и ткань сердца и почек, кишечная палочка и ткань толстого кишечника, гликопротеиды тимофеевки и гликопротеиды ВДП),
3) снятие тормозного влияния Т-супрессоров растормаживание супрессированных клонов против собственных тканей, компонентов ядра клеток, вызывает генерализованное воспаление соединительной ткани – коллагенозы [3].
Для выявления реагинового типа сенсибилизации:
1) радиоаллергосорбентный тест (RAST),
2) радиоиммуносорбентный тест (RIST),
3) прямой кожный тест,
4) реакция Праустница-Кюстнера,
Для выявления цитотоксического типа:
а) различные варианты метода иммунофлюоресценции,
в) реакция Штеффена,
г) радиоиммунологический метод.
Для выявления иммунокомплексного типа:
а) различные методы определения циркулирующих иммунных комплексов,
б) определение ревматоидного комплекса,
в) различные способы определения преципитирующих антител.
1) прямая кожная проба,
2) реакция бласттрансформации,
3) реакция торможения миграции макрофагов,
4) лимфотаксический эффект.
В иммунологическую стадию применяют левамизол и гормоны тимуса, которые регулируют иммунный ответ.
В патохимическую стадию: при реагиновом типе блокада высвобождение медиаторов из тучных клеток: интал, кетотифен, антигистаминные препараты, гистаглобулин (гистаминопексия), антисеротонинные препараты.
При цитотоксическом и иммунокомплексном типах антиферментные препараты, ингибирующие активность протеолитических ферментов и тем самым блокирующие системы комплемента и калликреин и др.
В патофихиологическую стадию лечение зависит от типа аллергии.
3) специфическая по Безредко А.М. (повторные дробные дозы через 30 мин 2-3 раза). Первые малые дозы связывают основную массу АТ, проигрывая минимальную реакцию, а затем основная доза препарата.