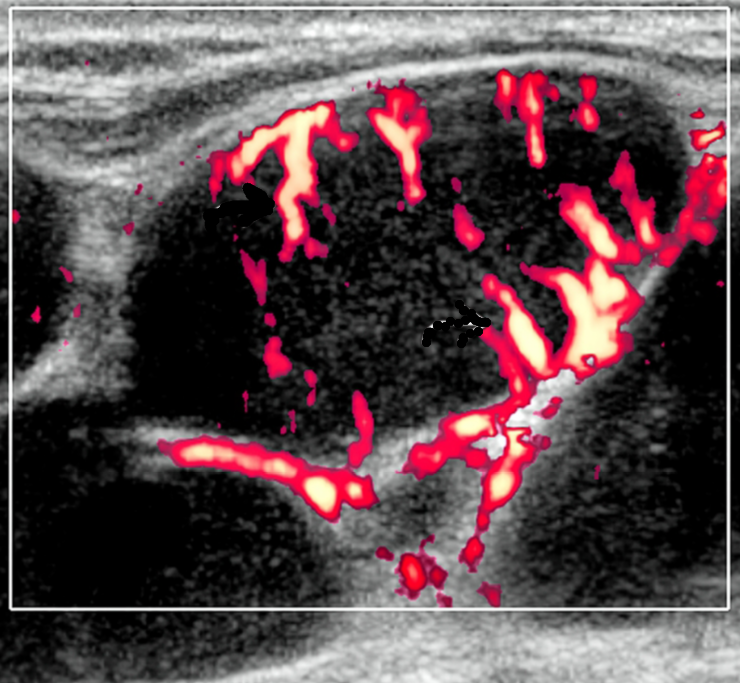
Гипоэхогенный лимфоузел что это
Лимфоузлы гипоэхогеннные на УЗИ
Добрый вечер. Обращалась вчера с вопросом. Сходила сегодня на УЗИ. Появилось еще 4 увеличенных подчелюстных лимфоузла.
Результат УЗИ:
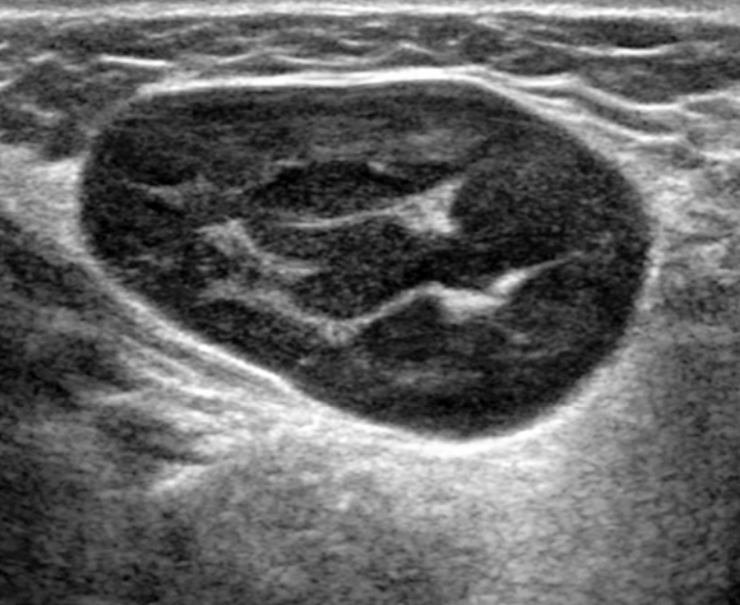
В подчелюстной области у угла нижней челюсти два гипоэхогенных лимфоузла с воротами л\у, расположенными по центру, соотношение длина\ширина >2\1, умеренно васкуляризированы, 18 и 16 мм в длину. Умеренно болезненны при исследовании. В подчелюстной области миндально л\н гипоэхогенный, 17*8 мм, дифференцированный.
Описание СЛЕВА:
В подчелютсной области у угла нижней челюсти дифференцированный лимфоузел 17*9 мм.
Заключение:
Лимфаденопатия подчелюстной области, больше справа.
Вопрос: почему узлы стали гипоэхогенными? Это сильно страшно? К какому врачу обратиться с этим? Не похоже ли это на лимфому? Месяц назад был только один лимфоузел 14 мм. Я очень боюсь.
Из симптомов: субфебрильная температура( если меряю 5 минут, то 36,6. если 10 минут, то 36,9-37,0), потливость в ногах( по ночам нет), упал вес на 2 кг, потеря аппетита( но думаю это психологическое).
Сдавала кровь методом ПЦР на Эпштейн Барр, Цитомегаловирус, ВИЧ, туберкулез(диаскин тест), герпес 1,2 и 6 типа. Все отрицательно. Стоматолог тоже все исключил.
Есть только хронический катаральный фарингит и вазомоторный ринит. Мазок из зева чистый.
Очень страшно, я очень боюсь, что это может оказаться онкологией. Куда идти дальше? Что делать?
Хронические болезни: Нейтропения уже средней тяжести( была тяжелой)
Метастатическое поражение шейных лимфатических узлов
Шейные лимфатические узлы являются частым местом метастазирования злокачественных опухолей, первичный очаг которых располагается в области головы и шеи. К ним, например, относятся плоскоклеточный рак верхних отделов дыхательных путей, а также метастазы рака слюнных желез и щитовидной железы.
Наиболее распространенным клиническим признаком является увеличивающееся образование шеи, которое обычно обнаруживается пациентом или его врачом. При подозрении на метастатическое поражения лимфатических узлов шеи для диагностики и определения наилучшей тактики лечения потребуется осмотр врачом-онкологом, инструментальные методы и биопсия.
Иногда новообразования вне области головы и шеи могут неожиданно метастазировать в шейные лимфатические узлы, что требует особенно тщательной диагностики для выявления первичного очага.
Лечение будет зависеть от типа и локализации первичной опухоли, которая распространилась в лимфатические узлы шеи, и, скорее всего, будет включать в себя комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
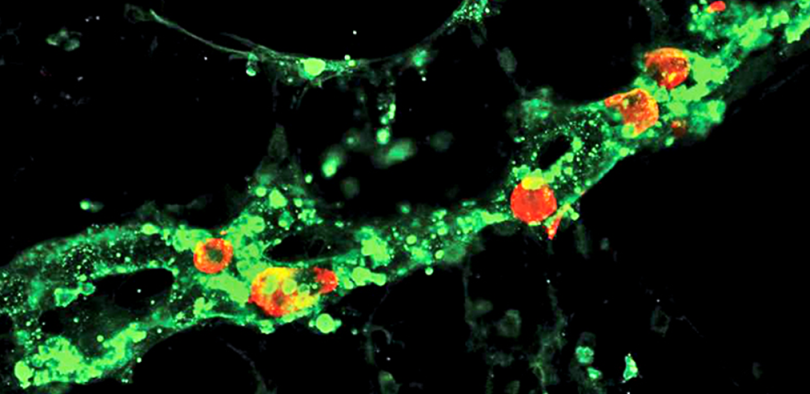
Иммунофлюоресцентная визуализация метастатических клеток меланомы (красные) внутри лимфатических сосудов (зеленые). Масштабная линейка: 100 мкм
(Science Advances/Michael Detmar Group ©)
Из чего состоит лимфатическая система шеи
Лимфатическая система шеи включает в себя сосуды и узлы.
Лимфатические капилляры — это тонкостенные структуры, состоящие из одного слоя эндотелиальных клеток. Они находятся во всех тканях организма и, объединяясь друг с другом, способствуют оттоку лимфатической жидкости в более крупные лимфатические сосуды.
Стенка лимфатических сосудов состоит из трех слоев: внутреннего слоя эндотелиальных клеток, среднего мышечного слоя и внешнего слоя соединительной ткани. В лимфатических сосудах гораздо больше клапанов, чем в венозных, при этом циркуляция лимфы полностью зависит от сжатия сосудов окружающими мышцами. Лимфатические сосуды дренируют лимфу в лимфатические узлы.
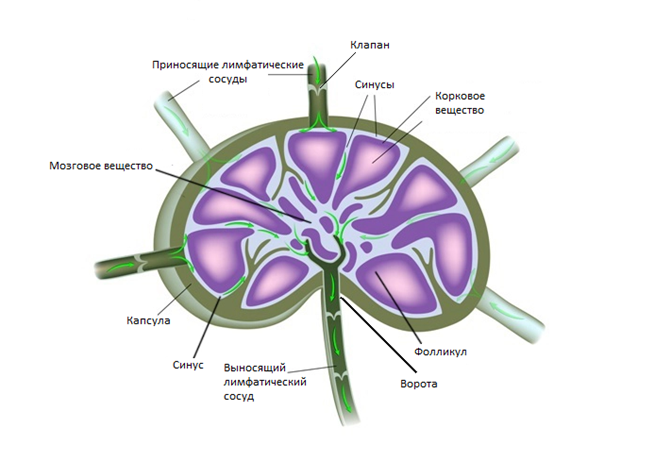
В среднем на каждой стороне шеи расположено до 75 лимфатических узлов. Снаружи узел покрывает капсула, под которой располагается субкапсулярные синусы – место куда попадает лимфатическая жидкость из приносящих лимфатических сосудов. Жидкость проходит сквозь ткань лимфатического узла, которая состоит из коркового и мозгового вещества, а затем выходит через ворота лимфатического узла и попадает в отводящие лимфатические сосуды. В итоге лимфа попадает в венозную систему в месте соустья внутренней яремной и подключичной вены.
Анатомическая структура лимфатического узла (Alila Medical Media/ Shutterstock ©)
Классификация лимфатических узлов шеи
На данный момент во всем мире рекомендована к использованию классификация Американского объединенного комитета по раку (American Joint Committee on Cancer (AJCC)) 8 издания от 2018 года:
Уровни лимфатических узлов шеи (Tenese Winslow LLC ©)
Диагностика
Осмотр
При пальпации шеи врач обращает внимание на расположение, размер, плотность и подвижность каждого узла. Особое внимание уделяется узлам, которые кажутся фиксированными к подлежащим сосудисто-нервным структурам и внутренним органам. Описание каждого узла становится важной частью медицинской документации, которая в дальнейшем может использоваться для оценки эффекта лечения.
Лучевые методы
Преимуществами УЗИ перед другими методами визуализации являются цена, скорость исследования и низкая лучевая нагрузка на пациента.
Ультразвуковыми признаками метастатического поражения лимфатических узлов может быть образование сферической формы, нарушение структуры, нечеткие границы, наличие центрального некроза и др.
Поскольку не всегда по УЗИ можно с уверенностью сказать является лимфатический узел пораженным или нет, иногда одновременно выполняют тонкоигольную аспирационную биопсию под ультразвуковым контролем с последующим цитологическим исследованием материала из этого узла. Результат цитологического исследования зависит от навыков врача УЗИ и качества образца (т.е. наличия достаточного количества репрезентативных клеток).
С появлением систем высокого разрешения и специальных контрастных веществ КТ позволяет обнаруживать лимфатические узлы, которые могли быть пропущены при иных методах диагностики.
Ценность МРТ – превосходная детализация мягких тканей. МРТ превосходит КТ в качестве предпочтительного исследования при оценке ряда новообразований головы и шеи, таких как основание языка и слюнные железы. Размер, наличие нескольких увеличенных узлов и центральный некроз – критерии, общие для протоколов исследования КТ и МРТ.
Этот новый метод визуализации все чаще используется для определения стадии опухолей головы и шеи. Метод основан на поглощении 2-фтор-2-дезокси-D-глюкозы (ФДГ) метаболически активными тканями. Исследование также может быть объединено с КТ, чтобы улучшить разрешение получаемого изображения и более точно определить расположение образования.
Биопсия
Биопсия — это удаление небольшого кусочка ткани для исследования под микроскопом или для тестирования в лаборатории на предмет наличия признаков злокачественности. В подавляющем большинстве случаев проводится тонкоигольная аспирационная биопсия. Врач, выполняющий биопсию, может использовать УЗИ или КТ для выполнения процедуры. Иногда тонкоигольная аспирационная биопсия не позволяет поставить окончательный диагноз, и требуются другие виды биопсии, такие как трепан-биопсия или эксцизионная биопсия.
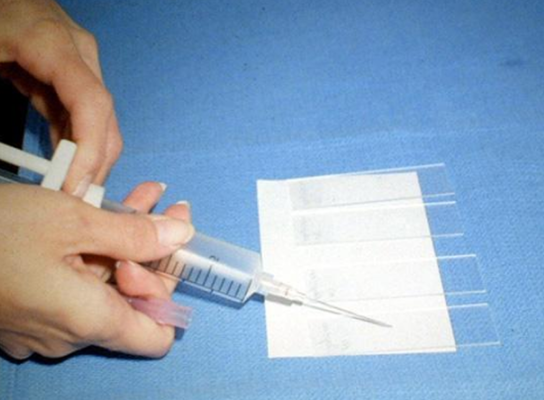 | 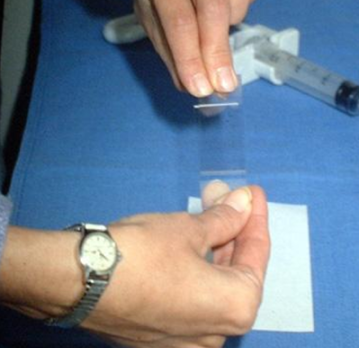 |
| Процесс приготовления предметных стекол для цитологического исследования. Материалом служит содержимое шприца после выполнения тонкоигольной аспирационной биопсии | |
План лечения
После определения диагноза и проведения всех диагностических исследований врач порекомендует оптимальный для пациента курс лечения. В конечном итоге лечение метастатического поражения лимфатических узлов зависит от типа и локализации первичной опухоли.
Существует три различных варианта лечения, которые могут быть использованы отдельно или в комбинации:
Хирургическое лечение
Хирургическое лечение обычно включает удаление лимфатических узлов шеи (лимфодиссекция) и последующее гистологическое исследование для точного определения стадии, так как это может существенно повлиять на дальнейшую тактику лечения. Хоть и не всегда, но чаще всего лимфодиссекция выполняется одновременно с удалением первичной опухоли.
Существуют различные виды лимфодиссекций:
Лучевая терапия
Лучевая терапия может быть назначена в качестве самостоятельного метода лечения в послеоперационном периоде, чтобы снизить вероятность рецидива либо в комбинации с химиотерапией в качестве самостоятельного или адъювантного лечения. Обычно адъювантная лучевая терапия необходима, если по результатам гистологического исследования обнаруживается несколько пораженных лимфатических узлов.
Химиотерапия
Химиотерапия обычно добавляется к лучевой терапии в качестве самостоятельного или адъювантного (послеоперационного) лечения. В некоторых случаях может использоваться индукционная химиотерапия с целью уменьшения объема образования и последующего хирургического вмешательства.
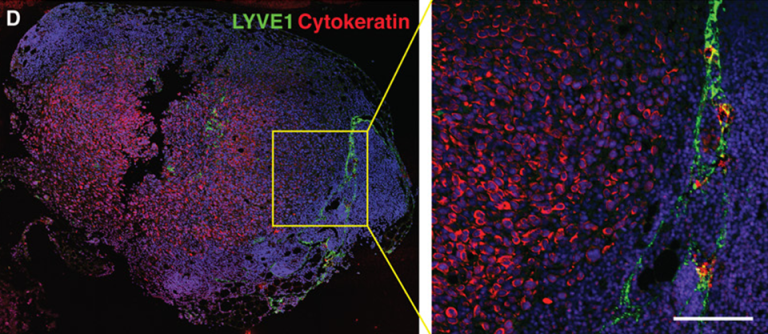
Иммунофлюоресцентная визуализация метастатически пораженного лимфатического узла с окраской на Цитокератин (красный) – маркер характерный для опухолевых клеток эпителиального происхождения. Масштабная линейка: 50 мкм
(Science Advances/Michael Detmar Group ©)
Прогноз
Метастазы в лимфатические узлы шеи могут возникать при онкологических заболеваниях различных локализаций, поэтому давать прогностические оценки для этой группы пациентов следует только после выявления первичной опухоли.
Факторы, влияющие на прогноз:
Наблюдение после лечения
Пациенты должны регулярно посещать своего специалиста по опухолям головы и шеи для оценки состояния на предмет любых признаков рецидива заболевания.
Стандартный график наблюдения
В первые 1–2 года осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – один раз в 6–12 месяцев. После 5 лет с момента операции посещать врача необходимо один раз в год или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы:
Авторская публикация:
Амиров Николай Сергеевич
Клинический ординатор НМИЦ онкологии им. Н.Н. Петрова
Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Ультразвуковое исследование лимфатических узлов при онкологических заболеваниях
Природа наделила наш организм лимфатической системой. Её функции заключаются в противостоянии негативным факторам внешней среды, защите от внешнего воздействия и фильтрации патогенных единиц.
Первичные раковые опухоли лимфатических узлов включают: лимфому Ходжкина, Неходжкинская лимфому и хронический лейкоз. Но, очень часто у пациентов встречается вторичное поражение лимфатических узлов метастазами при любом другом онкологическом заболевании. В связи с этим, специалисты обязательно включают ультразвуковое исследование лимфатических узлов в комплекс обследования больных с онкологическим заболеванием.
Онкологические пациенты могут проводить обследование лимфатических узлов на предмет воспаления или болезненности самостоятельно. Они расположены поверхностно и доступны к пальпации: на шее, на ключице, в подмышечной впадине и в паху.
При осмотре стоит обратить особое внимание на:
Если при обследовании выявляются настораживающие симптомы, то стоит запланировать визит ко врачу. После осмотра, он отправит больного на ультразвуковое исследование, которое позволит исключить или подтвердить наличие злокачественного процесса в лимфатических узлах. Поражение лимфатических узлов при онкологических заболеваниях имеет определенные ультразвуковые признаки.
Нормальный лимфатический узел имеет овальную форму с преобладанием длины над шириной, чёткие, ровные контуры с дифференцированными структурными элементами (рис.1).
При раковой опухоли лимфатической системы чаще всего бывает поражен не один, а группа лимфоузлов в нескольких областях. Они увеличиваются в размерах и визуализируются на экране в виде новообразования из слившихся лимфоузлов между собой или с близлежащими тканями. Контуры лимфоузлов чаще остаются четкими. Отмечается разрастание дополнительных кровеносных сосудов (рис.2)
Вторичное поражение (метастазы) лимфатических узлов характеризуется изменением формы на округлую с размытыми контурами (рис. 3). 
Все полученные результаты исследований обсуждаются с врачами клинических подразделений.
Применение УЗИ для оценки состояния поверхностных групп лимфатических узлов
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Введение
Лимфатические узлы представляют собой коллекторные органы, которые принимают участие в процессах обеззараживания организма и расположены в местах слияния нескольких лимфатических сосудов. Лимфатические узлы претерпевают структурные изменения на протяжении всей жизни человека. С момента рождения и до 12 лет лимфатические узлы находятся в стадии своего формирования. Затем наступает длительный период функциональной активности, который в старости заканчивается инволюцией лимфатического узла. При активизации лимфатического узла на фоне воспаления либо за счет других процессов происходит перестройка его внутренней структуры, увеличение размеров, при этом лимфатические узлы становятся пальпируемыми. Данное состояние лимфатических узлов клинически трактуется как аденопатия (лимфадениты). Доброкачественные аденопатий могут сопровождаться повышенной выработкой нормальных лимфоцитов, усилением васкуляризации, отеком либо замещением структур лимфатического узла на соединительную или жировую ткань [6].
Материалы и методы
Для изучения эхографической картины доброкачественных процессов в лимфатических узлах нами обследовано 326 пациентов с клинически определяемыми аденопатиями (в возрасте от 18 до 36 лет). Из них были выделена группа в 100 человек с доброкачественными изменениями в лимфатических узлах (в группу оценки умышленно не включались доброкачественные аденопатии при туберкулезном поражении и другой специфической инфекции лимфатических узлов).
После пальпаторного выявления измененных лимфатических узлов их дальнейший анализ осуществлялся на основании данных ультразвукового и морфологического (цитологического и гистологического) заключения. Пальпаторную оценку проводил врач-онколог. Морфологическое заключение было получено на основании цитодиагностики после тонкоигольной биопсии (45 случаев). У остальных пациентов подтверждение доброкачественности процесса было клиническим (динамическое наблюдение сроком 1-3 месяца).
Ультразвуковое исследование проводили на различных ультразвуковых аппаратах среднего и высокого класса. Эхографическое заключение давал специально обученный диагност.
За основу УЗ оценки были приняты следующие критерии:
Из группы лиц с доброкачественной аденопатией визуализировано 217 лимфатических узлов. При этом как правило выявлялось более двух лимфатических узлов на одной из сторон шеи.
Лимфоузлы при неходжкинской лимфомы на УЗИ
Основные факты при ультразвуковом исследовании лимфоузлов шеи при лимфоме
Основной дифференциальный диагноз
Клинические проблемы. Заболеваемость увеличивается с возрастом и у пациентов с ослабленным иммунитетом
Повышенная ассоциация с вирусом Эпштейна-Барра или HTLV-1 (Т-лимфотропный вирус), особенно с африканской болезнью Беркитта и СПИДом.
Диагностический контрольный список
Терминология. Сокращения. Неходжкинская лимфома (НХЛ). Определения. Рак, развивающийся в лимфо-ретикулярной системе, предположительно возникает из лимфоцитов и их производных
Основные характеристики при ультразвуковом сканировании шеи
Лучший диагностический признак на УЗИ. Множественные двусторонние ненекротически увеличенные узлы в обычных (яремная цепь, задний треугольник шеи) и необычных [ретрофарингеальное пространство (РФП), подчелюстное пространство (ПЧП), затылочные] узловые цепи. Может также представляться как один доминирующий некротический узел с несколькими меньшими окружающими лимфоузлами
Расположение. Поражение лимфатических узлов встречается в шейных цепях. Уровни II, III и IV часто участвуют в патологии. Поверхностная аденопатия, уровень V и спинномозговые узлы также распространенная проблема. Ненодальная лимфатическая болезнь встречается в небных миндалинах (наиболее распространенных), язычной ткани миндалин и аденоидах. Ненодальная экстралимфатическая болезнь встречается в околоносовых пазухах, основании черепа и щитовидной железе
Морфология. Лимфатические узлы круглые или овальные, как правило, без экстракапсулярного расширения
Если узлы показывают некроз ± экстранодальное распространение на УЗИ, подразумевается агрессивный HTLV-1. СПИД-ассоциированные лимфомы часто агрессивны
Ультрасонографические данные. Узлы НХЛ обычно круглые с четкими границами. Отложение опухоли в узлах создает больший акустический импеданс между узлом и прилегающими мягкими тканями, что приводит к резкой границе. Нерезкая граница указывает на экстракапсулярное распространение, подразумевая агрессивное заболевание неходжкинской лимфомы. Солидный узел и отсутствие нормальных эхогенных ворот встречается у 72-73% пациентов.
Обычно на УЗИ это гипоэхогенный лимфоузел по сравнению с соседними мышцами и ранее описывалось как псевдокистозные узлы с задним усилением. При использовании более старых преобразователей внутренние эхосигналы в узлах были очень низкими, почти анэхогенными, напоминающими кисту. Используя современные датчики высокого разрешения, несмотря на их солидную природу, мы видим, что узлы НХЛ имеют тенденцию к заднему усилению. Равномерная клеточная инфильтрация внутри узлов создает меньше границ между структурами и облегчает прохождение ультразвука. Это, в сочетании с низкой внутренней эхогенностью, приводит к так называемому псевдокистозу. Лимфоузлы неходжкинской лимфомы показывают интранодальный ретикулярный или микронодулярный рисунок с использованием более новых преобразователей высокого разрешения
Кальцификация на УЗИ встречается редко, и если присутствует, то обычно после лучевой терапии. Несмотря на большой размер лимфатических узлов, кистозный некроз встречается не часто, и если выявляется, то предполагает агрессивный тип неходжкинской лимфомы
Цветовой допплер: смешанная сосудистая сеть с выраженными внутриузловыми сосудами и наличием периферической сосудистой системы. Одна только периферическая сосудистая сеть редко встречается в узлах НХЛ. Спектральный допплер: переменное интранодальное внутрисосудистое сопротивление, которое носит неспецифический характер.
Результаты КТ. Плотность узлов ≤ мышц. Кальцификация чрезвычайно редка и, если присутствует, обычно после лучевой терапии. При КТ с контрастированием выявляются множественные яйцевидные образования в двух или нескольких цепях лимфатических узлов шеи. Единственный доминирующий однородный узел с рассеянными окружающими меньшими узлами. Лимфатические узлы могут быть различными по внешнему виду, начиная от изоденсных мышц и заканчивая диффузным усилением. Узловые образования могут казаться некротическими с периферическим усилением ободка и центральной частью низкой плотности. Можно увидеть переменную внешность у одного и того же пациента с некоторыми узлами низкой плотности и некоторыми кажущимися некротическими
МРТ данные
• T1WI. Узлы изоинтенсивны для мышц
• T2WI. Узлы гиперинтенсивные для мышц
• T1WI C +. Узлы усиливаются мягким, однородным образом. Некротическая аденопатия усиливается периферически
Результаты ядерной медицины. ПЭТ. Нодальный и ненодальный тип НХЛ сильно зависят от радиофармпрепарата. Изображения с Галлий-67 полезны для скрининга всего тела лимфомы, но имеют низкую специфичность
Дифференциальная диагностика при ультразвуковом исследовании шеи
Патология. Общие характеристики. Этиология. Моноклональная нерегулируемая пролиферация лимфоцитов.
Связанные аномалии. Часто ассоциируется со СПИДом как у детей, так и у взрослых. Нормальная узловая архитектура разрушена лимфомными клетками
Постановка диагноза, оценка и классификация
Критерии постановки стадии лимфом по Ann Arbor
Стадия I: один узловой регион или один экстралимфатический орган
Стадия II: вовлечение ≥2 узловых областей или поражение одиночного внелимфатического органа и смежных узлов на одной стороне диафрагмы
Стадия III: положительные узловые области с обеих сторон диафрагмы
Стадия IV: мультифокальное вовлечение с ≥ 1 экстралимфатическим органом
Клинические проблемы и проявления. Наиболее распространенные признаки / симптомы. Большая, безболезненная, маленькая, резиноподобная опухоль шеи. Системные симптомы: ночные поты, рецидивирующая лихорадка, необъяснимая потеря веса, усталость и кожная сыпь.
Клинический профиль. Безболезненная образование шеи у больного СПИДом чаще всего НХЛ
Демография. Возраст. Медиана: 50-55 лет. Пол. Мужчины: Женщины = 1,5: 1,0
Эпидемиология. НХЛ является вторым наиболее распространенным новообразованием головы и шеи. Неходжкинская лимфома = 5% всех случаев рака головы и шеи. Факторы риска НХЛ. Заболеваемость увеличивается с возрастом и с ослабленным иммунитетом. Четкая связь с вирусом Эпштейна-Барра или HTLV-1, особенно с африканскими лимфоцитами Беркитта и СПИДа.
Заболеваемость. Лимфома Ходжкина: 7000 случаев / год, Естественная история и прогноз. Непредсказуемая естественная история болезни, которая может перейти в постоянную или временную ремиссию или продолжать прогрессировать, несмотря на лучевую и химиотерапию. Прогноз зависит от стадии и реакции на терапию. Результат очень плохой в связанной со СПИДом НХЛ. Расчетные показатели излечения: I и II стадии: 85% с использованием лучевой терапии. Стадии II и IV: 50% с комбинированной лучевой терапией и химиотерапией
Лечение. Выбор лечения НХЛ зависит от стадии, типа клеток, возраста пациента. Обычно лечится с помощью лучевой (XRT) ± химиотерапией. Неходжкинская лимфома, ограниченная головой и шеей, может лечиться только с помощью XRT. Распространенную НХЛ лечат химиотерапией. Трансплантация костного мозга проводится в несколько этапов
Итог