Гепатодуоденальная связка что это такое простыми словами
Гепатодуоденальная связка что это такое простыми словами
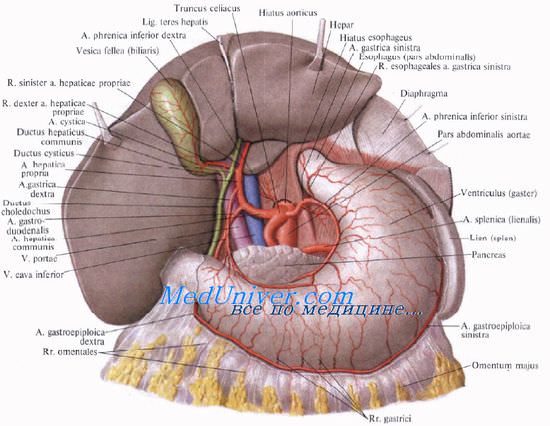
Печеночно-дуоденальная связка. Состав печеночно-дуоденальной связки. Кровоснабжение печени. Собственная печеночная артерия.
Печеночно-дуоденальная связка является правым краем малого сальника. Ее свободный правый край образует переднюю стенку сальникового отверстия. Между листками брюшины в связке справа проходит общий желчный проток, ductus choledochus, и формирующие его общий печеночный и пузырный протоки, слева и глубже лежит воротная вена, еще далее слева проходит печеночная артерия и ее ветви (для запоминания: Дуктус, Вена, Артерия — ДВА).
В самом нижнем отделе печеночно-дуоденальной связки проходят правые желудочные артерия и вена, a. et v. gastricae dextrae, и гастродуоденальные артерия и вена, a. et v. gastroduodenales. Вдоль артерий идут цепочки лимфатических узлов.
При кровотечении из печени можно, введя указательный палец в сальниковое отверстие, а большой палец положив на переднюю поверхность связки, временно сдавить кровеносные сосуды, проходящие в печеночно-дуоденальной связке.
Особенность кровоснабжения печени состоит в том, что кровь в нее приносится двумя сосудами: печеночной артерией и воротной веной.
Собственная печеночная артерия, a. hepatica propria, длиной от 0,5 до 3 см, является продолжением общей печеночной артерии, а. hepatica communis, которая, в свою очередь, отходит от чревного ствола, truncus coeliacus.
У ворот печени a. hepatica propria делится на ветви: ramus dexter и ramus sinister. В некоторых случаях отходит и третья ветвь, промежуточная, ramus intermedius, направляющаяся к квадратной доле.
Правая ветвь крупнее левой. Длина правой ветви — 2—4 см, диаметр — 2—4 мм. Она снабжает правую долю печени и частично хвостатую, а до этого отдает артерию к желчному пузырю — а. cystica. Левая ветвь снабжает кровью левую, квадратную и частично хвостатую доли печени. Длина левой ветви — 2—3 см, диаметр — 2—3 мм.
БИЛИАРНАЯ ДИСФУНКЦИЯ: определение, классификация, диагностика, лечение
Определение (патоморфологические предпосылки) Несмотря на то что билиарную систему (система желчных протоков и сфинктеров, регулирующих ток желчи) пытаются рассматривать отдельно от основного органа (печени), она является ее частью и в соответствии с
Определение (патоморфологические предпосылки)
Несмотря на то что билиарную систему (система желчных протоков и сфинктеров, регулирующих ток желчи) пытаются рассматривать отдельно от основного органа (печени), она является ее частью и в соответствии с этим функционирует.
В гепатоците условно выделяют 3 самостоятельных звена: синусоидальную, латеральную и каналикулярную части. Апикальная (каналикулярная) часть цитоплазматической мембраны гепатоцита отличается по гистологическим и биохимическим свойствам и участвует в образовании просвета желчного капилляра. Каждая печеночная клетка принимает участие в образовании нескольких желчных канальцев (ЖК). На периферии дольки ЖК сливаются в собственно желчные протоки, переходящие на выходе в междольковую соединительную ткань в междольковые канальцы, которые, сливаясь, образуют междольковые протоки первого порядка (второго — когда уже выстланы призматическим эпителием). В их стенках появляются трубчато-ацинозные слизистые железы, соединительно-тканная оболочка, эластические волокна. Междольковые протоки, сливаясь, образуют крупные печеночные протоки — долевые, выходящие из печени и, в свою очередь, образующие общий печеночный проток, продолжением которого служит общий желчный проток, его началом считается место соединения печеночного протока с пузырным. В общем желчном протоке различают супрадуоденальный, ретродуоденальный, ретропанкреатический, интрапанкреатический и интрамуральный отделы.
Дистальная часть общего желчного протока проходит в толще головки поджелудочной железы, и проток открывается на задней стенке нисходящего отдела двенадцатиперстной кишки, на 2–10 см ниже привратника. По сведениям разных авторов, ширина протоков может варьировать: общего желчного (ОЖ) — от 2 до 4 мм; печеночного — от 0,4 до 1,6 мм; пузырного — от 1,5 до 3,2 мм. Согласно рентгенологическим данным, ширина протока ОЖ — от 2 до 9 мм; по данным УЗИ — при наличии желчного пузыря (ЖП) — от 2 до 6 мм, а без желчного пузыря — от 4 до 10 мм. Вместимость желчного пузыря колеблется от 30 до 70 мл. В месте перехода желчного пузыря в пузырный проток мышечные волокна принимают циркулярное направление, формируя сфинктер протока ЖП (Люткенса). Двигательная иннервация осуществляется симпатической и парасимпатической нервной системой. Нервные сплетения имеются во всех слоях желчевыводящей системы. Чувствительные волокна ЖП способны воспринимать только растяжение.
Секреция желчи идет непрерывно в течение суток, с некоторыми колебаниями. За сутки выделяется от 0,5 до 2,0 л желчи. Направление движения желчи определяется взаимодействием печеночной секреции, ритмической деятельностью сфинктеров терминального отдела общего желчного протока, сфинктера желчного пузыря, клапана пузырного протока и всасывательной функцией слизистой оболочки желчного пузыря и всех протоков, что создает градиенты давлений. Из печеночных протоков и общего желчного протока желчь в ЖП поступает в момент закрытия сфинктера Одди (ему принадлежит решающая роль в создании градиента давления). Сфинктер Одди вне пищеварения закрыт непостоянно, и небольшие порции желчи систематически поступают в двенадцатиперстную кишку. После окончания пищеварительной фазы желчь попадает в желчный пузырь в течение 3 и более часов. Большинство исследователей считают, что внепеченочные желчные протоки никогда не находятся в покое, и их активная перистальтика рассматривается с точки зрения регуляции тока желчи; тонус двенадцатиперстной кишки (внутрипросветное давление) также влияет на выход желчи. Двигательная реакция желчного пузыря и сфинктера Одди находится в прямой зависимости от количества и качества пищи, а также от эмоционального состояния человека.
Мускулатура сфинктера Одди не зависит от мускулатуры двенадцатиперстной кишки. Сфинктер Одди состоит из: собственно сфинктера БДС (сфинктер Вестфаля), который обеспечивает разобщение протоков от двенадцатиперстной кишки; собственно сфинктера общего желчного протока; сфинктера панкреатического протока.
Работа всей билиарной системы строго координирована, что обеспечивается нервной и гуморальной регуляцией. До сих пор не совсем ясно регулирующее влияние эндогенных пептидов группы эндорфинов. Основным принципом всей регулирующей системы является саморегуляция разноуровневая (в том числе местно вырабатываемыми гормонами и биологически активными веществами).
Регулирующая составляющая очень сложна в физиологических условиях и не до конца ясна при различных патологиях этой системы.
Классификация, определение клинических вариантов дисфункции, диагностические подходы
Функциональные заболевания желчных путей представляют собой комплекс клинических симптомов, развившихся в результате моторно-тонической дисфункции желчного пузыря, желчных протоков и сфинктеров.
Согласно последней Международной классификации, вместо определения «функциональные заболевания билиарного тракта» (Римский консенсус, 1999) принят термин «дисфункциональные расстройства билиарного тракта». При этом, независимо от этиологии, их принято подразделять на 2 типа: дисфункция желчного пузыря и дисфункция сфинктера Одди.
В последней Международной классификации болезней (МКБ-10) под рубрикой К82.8 выделены только «дискинезия желчного пузыря и пузырного протока» и под рубрикой К83.4 — «спазм сфинктера Одди».
В регуляции двигательной активности билиарной системы принимают участие парасимпатический и симпатический отделы вегетативной нервной системы, а также эндокринная система, обеспечивающие синхронизированную последовательность сокращения и расслабления желчного пузыря и сфинктерного аппарата.
Показано, что умеренное раздражение блуждающего нерва вызывает координированную активность желчного пузыря и сфинктеров, а сильное раздражение — спастическое сокращение с задержкой эвакуации желчи. Раздражение симпатического нерва способствует расслаблению желчного пузыря. Из гастроинтестинальных гормонов максимальный эффект оказывает холецистокинин — панкреазимин (ХЦК-ПЗ), который, наряду с сокращением желчного пузыря, способствует расслаблению сфинктера Одди. Побудительным мотивом к выработке ХЦК-ПЗ является жирная пища, а к нервным регулирующим воздействиям — градиент давления и его изменение.
Основной причиной возникновения расстройств ритмической деятельности билиарной системы являются воспалительные процессы в печени, приводящие к нарушению синтеза желчи, заметному уменьшению давления в протоковой системе и желчном пузыре и, в связи с этим, к постоянному спастическому сокращению сфинктера Одди.
Различные оперативные вмешательства (холецистэктомия, ваготомия, резекция желудка) также приводят к существенным нарушениям функции билиарной системы. В отличие от процессов, протекающих в других органах пищеварения, образование желчи происходит непрерывно, однако поступление желчи в кишечник отмечается только в определенные фазы пищеварения. Это обеспечивается резервной функцией желчного пузыря и его ритмическими сокращениями с последовательным расслаблением сфинктеров Люткенса и Одди. Расслабление желчного пузыря сопровождается закрытием сфинктера Одди.
Различают первичные и вторичные дисфункциональные расстройства. Первичные встречаются редко и составляют в среднем 10–15%. При этом снижение сократительной функции желчного пузыря может быть связано как с уменьшением мышечной массы (редко), так и со снижением чувствительности рецепторного аппарата к нейрогуморальной стимуляции. Причем малое количество рецепторов может быть генетически детерминированным и благоприобретенным, вследствие воспалительных, дистрофических и метаболических расстройств. Вторичные дисфункциональные нарушения билиарного тракта могут наблюдаться при гормональных расстройствах, лечении соматостатином, при предменструальном синдроме, беременности, системных заболеваниях, диабете, гепатите, циррозе печени, еюностомии, а также при имеющихся воспалении и камнях в желчном пузыре. Причем наличие этих заболеваний не предполагает стабильной несостоятельности регулирующих систем и воспринимающего аппарата — речь идет о разной степени расстройств в разные периоды, фазы течения заболеваний; в связи с этим наблюдается «волнообразность» расстройств, вплоть до периодов довольно длительной стабильности, но с «легким» переходом данной системы от стабильности к расстройствам моторики. Важное значение при этом имеют психоэмоциональные перегрузки, стрессовые ситуации, общие неврозы. Для абсолютного большинства больных, перенесших холецистэктомию, характерна недостаточность сфинктера Одди с непрерывным истечением желчи, реже отмечается его спазм. Другой наиболее частой причиной билиарных расстройств является дистальная резекция желудка, приводящая к ослаблению гормональной регуляции и гипотонии желчного пузыря.
Классификация дисфункциональных расстройств билиарного тракта представлена в таблице.
Для простоты восприятия и более удобного применения на практике в классификации представлены однонаправленные расстройства, хотя в жизни они чаще носят сложный характер, с преобладанием одного из компонентов.
Клинические проявления достаточно хорошо известны: при гиперкинетических расстройствах возникают коликообразные боли различной интенсивности без иррадиации или с иррадиацией вправо, в спину, иногда в левую половину живота (при вовлечении протоковой системы поджелудочной железы). При гипокинезии — тупые боли в правом подреберье, чувство давления, распирания, усиливающееся при изменении положения тела и при увеличении внутрибрюшного давления, изменяющего градиент давления для тока желчи. Общими для разных форм дисфункции являются горечь во рту, вздутие живота, неустойчивый стул.
Итак, центральным симптомом дисфункции желчного пузыря является билиарный тип боли, причем единственной объективной характеристикой может считаться замедленное опорожнение желчного пузыря. Доступные методы диагностики не объясняют причину этого явления. Причинных факторов может быть несколько. Нельзя исключить такие моменты, как нарушение наполнения или снижение чувствительности воспринимающего аппарата желчного пузыря.
Диагностическими критериями дисфункции желчного пузыря являются эпизоды сильной постоянной боли, локализованной в эпигастрии или в правом верхнем квадранте живота, при этом характерны следующие особенности:
Очень важным объективным симптомом нарушенной моторики желчного пузыря является ультразвуковой феномен «сладжа» (осадка), который, по нашим данным [1], может быть представлен в 2 вариантах: а) диффузно; б) пристеночно. Пристеночный вариант, в зависимости от клинической ситуации, может быть охарактеризован как «воспалительный». Если воспаление отсутствует, тогда элементы осадка, формирующие его, являются достаточно крупными. Анализу должен быть также подвергнут весь клинический симптомокомплекс: тошнота и рвота, иррадиация, провоцирующие факторы (пища, ее качество и др.).
В отношении дисфункции сфинктера Одди выделяют 4 клинико-лабораторных типа (3 типа билиарной дисфункции и 1 тип панкреатической дисфункции). В основу диагностических критериев положены приступ болей билиарного типа и 3 лабораторно-инструментальных признака: подъем АСТ и/или ЩФ в 2 и более раз при двукратном определении; замедление выведения контрастных веществ при ЭРПХГ (более 45 мин); расширение общего желчного протока более 12 мм (исследования проводятся в период приступа).
Первый тип дисфункции характеризуется болями и 3 признаками.
Второй тип дисфункции отличается болями и 1 или 2 признаками.
Третий тип — только приступом болей.
Четвертый тип — панкреатический — характеризуется «панкреатическими» болями и повышением уровня амилазы или липазы (при несильных болях); повышение ферментов (амилазы, липазы) может отсутствовать.
В тех случаях, когда эндоскопическая ретроградная панкреато-холангиография исключает отсутствие стриктурной патологии, показана монометрия билиарного и панкреатического сфинктеров.
Всемирный конгресс гастроэнтерологов (Бангкок, 2002) определил, что медицина, основанная на доказательствах, требует не консенсуса, а именно наличия доказательств. Участники конгресса пришли к выводу, что дисфункцию сфинктера Одди следует отнести не к четко определенным заболеваниям, а к состоянию с вариабельным взаимоотношением дисфункция/симптом. Особо было подчеркнуто, что нарушенное опорожнение желчного пузыря хорошо известно как следствие воспалительного повреждения, механической обструкции или автономной денервации. В отсутствии этих условий неясно, можно ли рассматривать замедленное опорожнение желчного пузыря как определенную клиническую проблему (нозологическую форму).
Некоторые принципы лечения дисфункциональных билиарных расстройств
Учитывая вышеизложенное, следует отметить, что основная цель лечения больных дисфункциональными расстройствами билиарного тракта состоит в восстановлении нормального тока желчи и секрета поджелудочной железы по билиарным и панкреатическим протокам. В связи с этим в задачи лечения входят:
До сих пор в системе лечебных мероприятий заметную роль занимает диетотерапия. Общими принципами диеты являются режим питания с частыми приемами небольшого количества пищи (5–6-разовое питание), что способствует нормализации давления в двенадцатиперстной кишке и регулирует опорожнение желчного пузыря и протоковой системы. Из рациона исключаются алкогольные напитки, газированная вода, копченые, жирные и жареные блюда, приправы — в связи с тем, что они могут вызвать спазм сфинктера Одди. При подборе диетического рациона учитывают влияние отдельных пищевых веществ на нормализацию моторной функции желчного пузыря и желчевыводящих путей. Так, при гиперкинетическом типе дисфункции должно быть резко ограничено потребление продуктов, стимулирующих сокращение желчного пузыря, — животных жиров, растительных масел, наваристых мясных, рыбных и грибных бульонов. При гипотонии желчного пузыря больные обычно хорошо переносят некрепкие мясные и рыбные бульоны, сливки, сметану, растительные масла, яйца всмятку. Растительное масло назначают по чайной ложке 2–3 раза в день за 30 мин до еды в течение 2–3 нед. Для предотвращения запоров рекомендуют блюда, способствующие опорожнению кишечника (морковь, тыква, кабачки, зелень, арбузы, дыни, чернослив, курага, апельсины, груши, мед). Это особенно важно, так как нормально работающий кишечник означает нормализацию внутрибрюшного давления и наличие нормального продвижения желчи в двенадцатиперстную кишку. Использование пищевых отрубей (при достаточном количестве воды) важно не только для работы кишечника, но и для моторики билиарного тракта, особенно желчного пузыря, имеющего осадок.
Из лекарственных препаратов, влияющих на моторную функцию желудочно-кишечного тракта, используют: антихолинергические препараты, нитраты, миотропные спазмолитики, интестинальные гормоны (ХЦК, глюкагон), холеретики, холекинетики.
Антихолинергические средства, снижая концентрацию внутриклеточных ионов кальция, приводят к расслаблению мышц. Интенсивность расслабления зависит от исходного тонуса парасимпатической нервной системы, но при использовании препаратов данной группы наблюдается широкий спектр побочных эффектов: сухость во рту, затрудненное мочеиспускание, нарушение зрения, что существенно ограничивает их применение.
Неселективные блокаторы кальциевых каналов (нифедипин, верапамил, дилтиазем и др.) способны расслабить гладкую мускулатуру, в том числе и билиарного тракта, но это требует максимально высоких доз, что практически исключает использование этих препаратов из-за выраженных кардиоваскулярных эффектов.
Некоторые спазмолитики селективно блокируют кальциевые каналы (дицетел, панаверия бромид, спазмомен) и преимущественно действуют на уровне толстой кишки, где они и метаболизируются. 5–10% этих препаратов всасывается и метаболизируется в печени и может работать на уровне билиарного тракта. Эта сторона требует дальнейших исследований, а опосредованные эффекты, связанные с восстановлением градиента давления, отмечены и могут быть использованы.
В настоящее время среди миотропных спазмолитиков обращает на себя внимание препарат гимекромон (одестон), который оказывает избирательное спазмолитическое действие на сфинктер Одди и сфинктер желчного пузыря. Одестон эффективен у больных с дисфункцией билиарного тракта, обладает желчегонным действием, устраняет билиарную недостаточность, а также дисфункцию сфинктера Одди, его гипертонус, в том числе и у больных после холецистэктомии.
Из других миотропных спазмолитиков следует отметить дюспаталин, который селективно влияет на тонус сфинктера Одди (непосредственно и опосредованно), он лишен универсального спазмолитического эффекта (и, следовательно, побочных действий), но не обладает холеретическим эффектом и в этом уступает одестону.
При гипофункции желчного пузыря основным подходом к лечению следует считает фармакотерапевтический.
Использование препаратов, усиливающих моторику желчного пузыря.
Холекинетики: сульфат магния, оливковое масло и другие масла, сорбит, ксилит, холосас и др.
Выбор препарата, являющийся очень важным, если не основным вопросом, зависит от того, как быстро необходимо получить эффект от терапии. Если требуется максимально быстрое воздействие на организм больного, то лучше использовать холекинетики, причем эффект зависит и от дозы препарата; если необходимо длительное курсовое лечение, то применяются желчесодержащие препараты; если требуется одновременно и противовоспалительное действие, то выбор должен быть сделан в пользу синтетических препаратов, но курсовое лечение ими будет непродолжительным; когда у пациента одновременно имеется патология печени, то выбор должен быть сделан в пользу хофитола, обладающего холеретическим и протективным действием.
Использование препаратов, обладающих прокинетическим воздействием
(мотилиум, дебридат). Сюда же могут быть отнесены миотропные спазмолитики: дицетел, спазмомен, дюспаталин, галидор, но-шпа. Следует помнить, что их эффекты, как правило, носят опосредованный характер (уменьшают либо тонус сфинктера Одди, либо давление в двенадцатиперстной кишке). Их эффективность дозозависима, поэтому необходим подбор действенной дозы.
Использование препаратов, уменьшающих воспаление и висцеральную гипералгезию. Нестероидные противовоспалительные средства: анопирин, упсарин УПСА, диклоберл, наклофен, кетанов, солпафлекс, брустан, кетонал, мовалис, доналгин, амбене, целебрекс и низкие дозы трициклических антидепрессантов (амизол, саротен, эливел, мелипрамин, коаксил).
Необходимо обратить внимание и на другие аспекты лечения. При дисфункции сфинктера Одди: при установлении первого типа требуется проведение папиллосфинктеротомии; второго-третьего типа — допускается возможность назначения лекарственной терапии. Следует иметь в виду, что гормоны (ХЦК, глюкагон) могут временно снижать тонус сфинктера Одди; нитраты дают очень кратковременный эффект. Ботулинический токсин — сильный ингибитор выделения ацетилхолина. Использование его в виде инъекций в сфинктер Одди уменьшает его давление, улучшает ток желчи и приносит облегчение, но эффект лечения преходящий. При панкреатическом типе дисфункции сфинктера Одди стандартной терапией являются оперативная сфинктеропластика и панкреатическая литопластика (лекарственное воздействие осуществляется только на стадии отсутствия осложнений).
Заключение
В последнее время внимание медицинской общественности оказалось привлечено к функциональным расстройствам желудочно-кишечного тракта вообще и билиарной системы в частности. Это связано в значительной степени с тем, что в отношении функциональных расстройств остается надежда на их излечение, а также успешную профилактику или отдаление по времени развития более тяжелой в прогностическом отношении органической патологии (в том числе и онкологической). Сегодня вырабатываются диагностические подходы к лечению рассмотренных нами заболеваний, представленные в настоящей статье. Кроме того, в данной работе нашел отражение большой арсенал лекарственных средств, находящихся в распоряжении врача, который имеет возможность выбрать препарат или комплекс в зависимости от патогенетических особенностей конкретного расстройства.
Литература
О. Н. Минушкин, доктор медицинских наук, профессор
Медицинский центр Управления делами Президента РФ, Москва
Гепатодуоденальная связка что это такое простыми словами
В настоящее время все более весомое значение в решении сложных задач дифференциальной диагностики заболеваний панкреатобилиарной системы отводится эндоскопической ультрасонографии (ЭУС, EUS). С развитием медицинских технологий появилась перспектива внедрения в клиническую практику новых методик, выполняемых при эндоскопическом ультразвуковом исследовании, таких как контрастное усиление (CH-EUS). Указанная методика значительно расширит возможности дифференциальной диагностики заболеваний панкреатобилиарной системы. На сегодняшний день актуальной задачей является оценка диагностической точности и определение места контрастного усиления в диагностическом алгоритме обследования пациентов с заболеваниями поджелудочной железы.
Приводим клиническое наблюдение пациентки с образованием общего желчного протока, при котором использование CH-EUS определении тактики лечения.
Ключевые слова: эндоскопическая ультрасонография, контрастное усиление, образование общего желчного протока, тубулярно-ворсинчатая аденома.
Введение
В настоящее время все более весомое значение в диагностике заболеваний панкреатобилиарной системы (ПБС) отводится эндоскопической ультрасонографии. С развитием медицинских технологий появилась перспектива внедрения в клиническую практику новых методик, выполняемых при эндоскопическом ультразвуковом исследовании, таких как контрастное усиление. Указанная методика значительно расширяет возможности дифференциальной диагностики заболеваний ПБС [1, 2, 3].
По данным европейских и японских исследователей, эндоскопическая ультрасонография с контрастированием является принципиально новым методом эндосонографической диагностики, позволяющим произвести качественный и количественный анализ степени васкуляризации исследуемого объекта, что способствует объективной диагностике непосредственно во время эндоскопического ультразвукового исследования [4, 5, 6, 7].
Практическое использование контрастов для усиления эхо-сигнала началось в 1982 году в эхокардиографии [8]. В 1990 году появилось первое поколение ультразвуковых аппаратов с контрастным усилением для исследования брюшной полости [9]. Первые положительные результаты использования контраста при УЗИ печени дали начало активного применения этой технологии для других паренхиматозных органов [10].
Газовые пузырьки контрастного вещества первого поколения не были достаточно устойчивыми для непрерывного ультразвукового сканирования. В 2001–2002 гг. было введено в использование новое поколение контрастных веществ на основе высокоплотных газов (Sonovue и др.), которые не выходят за пределы кровеносного русла, а их распределение в организме полностью совпадает с распределением эритроцитов [11]. В последующем на основе биополимеров (Sonovist) были разработаны препараты третьего поколения, состоящие из заполненных газом микросфер, средний диаметр которых составляет 1 мкм. Оболочка микропузырька представляет собой тончайший слой саморазрушающегося полимера. Препарат стабилен в течение нескольких часов и избирательно накапливается в печени и селезенке.
Поскольку при обычной частоте ультразвуковой волны разрушение микропузырьков происходило очень быстро, производители ультразвуковой аппаратуры предусмотрели специальный режим получения изображений при низком механическом индексе (МИ) для использования контрастного вещества [12]. Этот режим позволил поддерживать колебания микропузырьков и визуализировать их в паренхиматозной ткани в режиме реального времени. Благодаря возможности непрерывного ультразвукового сканирования в период притока контрастного вещества и его распределения в тканях оценивается динамика контрастного усиления.
Первый опыт CH-EUS с использованием нового линейного прототипа эхоэндоскопа сообщили Kitano М. и соавт. [13]. Первоначально они проводили эксперименты на животных моделях, затем на двух пациентах, один из которых с раком поджелудочной железы, а другой с гастроинтестинальной стромальной опухолью. Исследователи сделали вывод о возможной роли CH-EUS при исследовании некоторых заболеваний пищеварительного тракта. Далее те же авторы продолжили исследование, чтобы оценить потенциал CH-EUS в клиническом применении [14]. В общей сложности были проанализированы результаты обследования 104 пациентов. После чего сделан вывод, что СН-EUS является перспективным неинвазивным методом для оценки перфузии и микроциркуляции исследуемого образования и играет важную роль в дифференциальной диагностике заболеваний панкреатобилиарной системы.
На данный момент в России в качестве контрастного препарата используется Sonovue, который был лицензирован в 2013 году, и с тех пор отечественные специалисты ультразвуковой диагностики и эндосонографии накапливают собственный опыт применения данного препарата при различных заболеваниях панреатобилиарной системы и желудочно-кишечного тракта. Sonovue содержит микропузырьки высокоплотного газа гексафторида серы, который является инертным веществом и не имеет фармакологического действия. Физический эффект состоит во взаимодействии микропузырьков и ультразвуковых волн, что приводят к появлению эхо-сигнала (контрастное усиление). Препарат не нарушает функцию щитовидной железы, не обладает нефротоксичностью и может применяться независимо от степени снижения функции почек пациента. Sonovue контрастирует исключительно сосуды и быстро выводится из системы кровообращения с выдыхаемым воздухом.
В Московском клиническом научном центре имени А. С. Логинова с 2016 года накапливается опыт использования контрастного усиления под контролем ЭУС. Данный метод применяется при неинформативности других методов исследования и при сложности постановки диагноза при проведении ЭУС.
В данной статье приводится пример использования контрастного усиления при проведении эндоскопической ультрасонографии в дифференциальной диагностике заболевания общего желчного протока.
Клинические наблюдения
Пациентка К., 70 лет
Поступила В МКНЦ с жалобами на желтуху, кожный зуд. Анамнез заболевания: считает себя больной с января 2017 года, когда отметила снижение веса на 22 кг за последние три месяца, пожелтение кожных покровов. Обратилась в поликлинику по месту жительства, обследована, выявлено повышение уровня билирубина до 40 мкмоль/л (прямой – 36,5). На УЗИ брюшной полости от 21.02.2017 г. – расширение внутри и внепеченочных желчных протоков, эхогенное содержимое в общем желчном протоке, увеличение размеров головки поджелудочной железы.
С клиникой механической желтухи пациентка была госпитализирована в отделение высокотехнологичной хирургии и хирургической эндоскопии Московского клинического научного центра имени А. С. Логинова для обследования и определения тактики лечения.
В биохимическом анализе крови отмечалось повышение уровня следующих показателей: АЛТ 40,8 Ед/л, АСТ 55,5 Ед/л, билирубин общий 158,0 мкмоль/л (прямой – 82,0 мкмоль/л, непрямой – 76,0 мкмоль/л), глюкоза 10,17 мкмоль/л, гамма-глутамилтрансфераза 159 Ед/л, щелочная фосфатаза 158,0 Ед/л. В иммунологическом исследовании отмечалось повышение CA 19–9 до 35,6 Ед/мл.
Ультразвуковое исследование органов брюшной полости: желчные протоки расширены в обеих долях (сегментарные до 4–6 мм, долевые до 10–11 мм), общий желчный проток расширен до 18 мм, в его терминальном отделе определяются гипоэхогенное неоднородные содержимое, на уровне головки поджелудочной железы – полностью обтурирующие ОЖП, неравномерно суживая внутренний его просвет на протяжении не менее 50 мм.
Заключение: билиарный сладж? Образование терминального отдела холедоха? Выраженная билиарная гипертензия.
Мультиспиральная компьютерная томография органов брюшной полости, в/в контрастирование: печень в размерах увеличена (256 х 124 х 185 мм), с ровными четкими контурами. Плотность паренхимы 40 ед.Н, на этом фоне сосудистый рисунок определяется. При нативном сканировании структура паренхимы печени гомогенная. При контрастировании – гипо- и гиперденсных образований не выявляется, сосудистая система прослеживается на всем протяжении. Ширина ствола воротной вены 13 мм. Элементы ворот печени дифференцированы.
Внутри- и внепеченочные желчные протоки расширены: сегментарные до 4 мм, общий печеночный проток до 16 мм. Определяется образование общего желчного протока на уровне панкреатического/ретродуоденального отдела до впадения пузырного протока в виде внутрипросветной изоденсной структуры протяженностью до 25 мм и общей толщиной до 20 мм. Плотность образования 34–40 ед Н, накапливает препарат в АФ до 52 ед. Н, в ВФ до 67 ед. Н, в ОФ 53 ед. Н. По переднему контуру образования холедоха проходит правая долевая печеночная артерия. Ширина общего желчного протока в дистальном отделе до 9 мм. Лимфоузлы: по ходу гепатодуоденальной связки до 10 х 24 мм, парааортальные и аортокавальные до 5 мм. Определяется парафатеральный дивертикул диаметром 9 мм, содержимое дивертикула – газ.
Заключение: КТ картина образования средней-нижней трети общего желчного протока (c-r? сладж?) с расширением внутри- и внепеченочных билиарных протоков. Регионарная лимфаденопатия. Парафатеральный дивертикул.
Эндоскопическая ультрасонография с контрастным усилением: внутрипеченочные желчные протоки немного расширены. Гепатикохоледох в проксимальном отделе до 18 мм, стенки немного утолщены, в просвете гиперэхогенная взвесь. От уровня пузырного протока стенки общего желчного протока ассиметрично утолщены за счет папиллярных разрастаний внутрипротоково стелящейся опухоли и наличия неоднородного содержимого (рис. 1). В режиме ЦДК определяются сигналы. Преампулярная и интраампулярная части протока имеет анэхогенный просвет, стенки немного утолщены.
БДС округлой формы, средней эхогенности, размерами до 10 мм, в проекции БДС диаметр ОЖП до 1,5 мм, ГПП – до 1,0 мм. Парапапиллярно определяется дивертикул до 1,0 см. По ходу гепатодуоденальной связки лимфатический узел до 14х11мм.
Поджелудочная железа: эхогенность паренхимы понижена, структура неоднородная. ГПП в головке до 3,0 мм, в теле 2,0 мм, ход прямой, просвет свободный.
Для верификации кистозного содержимого необходимо проведение контрастного усиления. При введении Sonovue в раннюю фазу (10–30 с после в/в инъекции) отмечалось активное накопление контраста образованием (гиперусиление), которое сохранялось и позднюю фазу (31–180 с после в/в инъекции) с последующим медленным вымыванием контрастного вещества (рис. 2). Накопление контраста было усиленное и равномерное, что характерно для доброкачественного характера образования.
Заключение: сонографические признаки «стелящейся опухоли» общего желчного протока (внутрипротоковая папиллярная неоплазия желчного протока?). Парафатериальный дивертикул. Увеличение лимфатических узлов по ходу гепатодуоденальной связки. Диффузные изменения поджелудочной железы
Магнитно-резонансная холангиография: внутрипеченочные желчные протоки умеренно расширены, долевые до 6 мм, не дифференцируются. Конфлюенс обычного типа. Гепатикохоледох до 15 мм, в просвете его имеются множественные пристеночные структуры с признаками ограничения диффузии. Желчный пузырь сокращен.
Заключение: образование общего желчного протока? Лимфаденопатия лимфатических узлов гепатодуоденальной связки.
На основании полученных данных пациентке поставлен диагноз: «опухоль общего желчного протока, TXNXM0». Принято решение выполнить оперативное вмешательство в объеме лапароскопической резекции внепеченочных желчных протоков и формирование билиодигестивного соустья по Ру.
Оперативное вмешательство: лапароскопическая резекция внепеченочных желчных протоков; формирование билиодигестивного соустья по Ру; дренирование брюшной полости (интраоперационно: с помощью УЗ-скальпеля произведена мобилизация общего печеночного и общего желчного протока, желчного пузыря «от дна»). При инструментальной пальпации выявлено мягкотканое образование холедоха, распространяющееся на ретродуоденальную часть. Произведена мобилизация холедоха дистально до неизмененных тканей протока. О перевязан нитью пролен 1–0, отсечен холодными ножницами. Из просвета поступает слизеобразное содержимое. Тотчас выше впадения пузырного протока пересечен общий печеночный проток. Препарат извлечен (рис. 3).
Гистологическое исследование операционного материала: стенка общего желчного протока представлена грубоволокнистой соединительной тканью, определяется рост тубулярных и ворсинчатых структур с полной кишечной метаплазией, инвазии в мышечный слой стенки не наблюдается, строма отечная (рис. 4). В дистальном крае резекции элементов опухолевого роста не обнаружено.
Заключение: морфологическая картина соответствует тубуло-ворсинчатой аденоме общего желчного протока.
Заключение
Внутрипротоковая папиллярная неоплазия желчного протока (Intraductal papillary neoplasm of the bile duct – IPNB) является редко встречающейся опухолью, которая недавно была классифицирована как отдельная группа заболеваний [15]. IPNB, согласно классификации, включает аденому, карциному in-situ и инвазивную карциному. Опухоль может развиваться в любой части желчных протоков и, как правило, характеризуется экзофитным ростом [16]. В большинстве случаев IPNB наблюдается расширение желчных протоков и в трети случаев сопровождается повышенным муцинобразованием, что может вызвать холангит или обструктивную желтуху [17]. IPNB является эквивалентом сходной патологии панкреатических протоков – внутрипротоковой папиллярной муцинозной неоплазии поджелудочной железы (intraductal papillary mucinous neoplasm of the pancreas – IPMN-P) [4].
Таким образом, учитывая наличие роста в стенке слизистой общего желчного протока тубулярных и ворсинчатых структур без обнаружения атипии, данное образование было расценено как тубуло-ворсинчатая аденома общего желчного протока.
В представленном клиническом примере контрастное усиление под контролем эндосонографии позволило подтвердить тканевую структуру выявленного образования, предположить его доброкачественность и принять решение о виде оперативного вмешательства с целью устранения выраженной билиарной гипертензии.
Литература
Seicean A., Mosteanu O., Seicean R. Maximizing the endosonography: The role of contrast harmonics, elastography and confocal endomicroscopy. // World journal of gastroenterology. – 2017. – Jan 7. – №23 (1). – Р. 25–41.
Alvarez-Sánchez M. V., Napoléon B. Contrast-enhanced harmonic endoscopic ultrasound imaging basic principles, present situation and future perspectives. // World journal of gastroenterology. – 2014. – November. – №14; 20 (42): 15549–15563.
Napoleon B., Alvarez-Sanchez M. V., Gincoul R., Pujol B., Lefort C., Lepilliez V., Labadie M., Souquet J. C., Queneau P. E., Scoazec J. Y., Chayvialle J. A., Ponchon T. Contrast-enhanced harmonic endoscopic ultrasound in solid lesions of the pancreas: results of a pilot study. // Endoscopy. – 2010. – Jul. – №42 (7): 564–70.
Figueiredo F. A., da Silva P. M., Monges G., Bories E., Pesenti C., Caillol F., Delpero J. R., Giovannini M. Yield of Contrast-Enhanced Power Doppler Endoscopic Ultrasonography and Strain Ratio Obtained by EUS-Elastography in the Diagnosis of Focal Pancreatic Solid Lesions. // Endoscopic ultrasound. – 2012. – Oct. – №1 (3): 143–9.
Kitano M., Kamata K., Imai H., Miyata T., Yasukawa S., Yanagisawa A., Kudo M. Contrast-enhanced harmonic endoscopic ultrasonography for pancreatobiliary diseases. // Digestive Endoscopy. – 2015. – Apr. – № 27. Suppl 1:60–7.
Săftoiu A., Vilmann P., Dietrich C. F., Iglesias-Garcia J., Hocke M., Seicean A., Ignee A., Hassan H., Streba C. T., Ioncică A. M., Gheonea D. I., Ciurea T. Quantitative contrast-enhanced harmonic EUS in differential diagnosis of focal pancreatic masses. // Gastrointestinal Endoscopy. – 2015. – Jul. – №82 (1). – Р. 59–69.
Gincul R., Palazzo M., Pujol B., Tubach F., Palazzo L., Lefort C., Fumex F., Lombard A., Ribeiro D., Fabre M., Hervieu V., Labadie M., Ponchon T., Napoléon B. Contrast-harmonic endoscopic ultrasound for the diagnosis of pancreatic adenocarcinoma: a prospective multicenter trial. // Endoscopy. – 2014. – May. – №46 (5): 373–9.
Armstrong W. F., Mueller T. M., Kinney E. L. Assessment of myocardial perfusion abnormalities with contrast-enhanced two-dimensional echocardiography. // Circulation. – 1982. – №66 (1): 166–17.
Fritzsch T., Hilmann J., Kämpfe M., Müller N., Schöbel C., Siegert J. SH U 508, a transpulmonary echocontrast agent. // Investigative Radiology. – 1990. – №25 (1). – Р. 160–161.
Angeli E., Carpanelli R., Crespi G., Zanello A., Sironi S., Del Maschio A. Efficacy of SH U 508 A (Levovist) in color Doppler ultrasonography of hepatocellular carcinoma vascularization. // Radiologia Medica. – 1994. – №87 (5, supplement 1): 24–31.
Arditi M., Brenier T., Schneider M. Preliminary study in differential contrast echography. // Ultrasound in Medicine and Biology. – 1997. – №23 (8). – Р. 1185–1194.
Bauer A., Solbiati L., Weissman N. Ultrasound imaging with SonoVue: low mechanical index real-time imaging. // Academic Radiology. – 2002. – №9 (2). – Р. 282–284.
Kitano M., Kudo M., Sakamoto H., Nakatani T., Maekawa K., Mizuguchi N., Ito Y., Miki M., Matsui U., von Schrenk T. Preliminary study of contrast-enhanced harmonic endosonography with second generation contrast agents. // Journal of Medical Ultrasonics. – 2008. – №35. – Р. 11–18.
Kitano M., Sakamoto H., Matsui U., Ito Y., Maekawa K., von Schrenck T., Kudo M. A novel perfusion imaging technique of the pancreas: contrast-enhanced harmonic EUS. // Gastrointestinal Endoscopy. – 2008. – Jan. – №67 (1): 141–50.
Zen Y., Fujii T., Itatsu K., Nakamura K., Minato H., Kasashima S. Biliary papillary tumors share pathological features with intraductal papillary mucinous neoplasm of the pancreas. // Hepatology (Baltimore, Md). – 2006. – №44 (november (5)). – Р. 1333–1343.
Paik K. Y., Heo J. S., Choi S. H., Choi D. W. Intraductal papillary neoplasm of the bile ducts: the clinical features and surgical outcome of 25 cases. // J. Surg. Oncol. – 2008. – №97 (may (6)). – Р. 508–512.
Kubota K., Nakanuma Y., Kondo F., Hachiya H., Miyazaki M., Nagino M. Clinicopathological features and prognosis of mucin-producing bile duct tumor and mucinous cystic tumor of the liver: a multi-institutional study by the Japan Biliary Association. // J. Hepato-Biliary-Pancreatic Sci. – 2014. – №21 (march (3)). – Р. 176–185.
Gordon-Weeks A. N., Jones K., Harriss E., Smith A., Silva M. Systematic review and meta-analysis of Current Experience in Treating IPNB: clinical and pathological correlates. // Ann. Surg. – 2016. – №263 (аpril (4)). – Р. 656–663.